
【题目】“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
②C(s)+2H2(g)![]() CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③2CO(g)![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4 和H2O(g)的热化学方程式: __________________。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2L的密闭容器中,充入1 molCO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
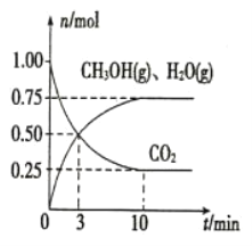
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________。
②下列措施一定不能使CO2的转化率增大的是_____________(选填编号)。
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中再充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)中CO的平衡转化率随
H2(g)+CO2(g)中CO的平衡转化率随![]() 及温度变化关系如图所示:
及温度变化关系如图所示:
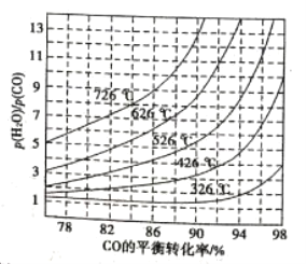
①上述反应的逆反应方向是_____________反应(填“吸热”或“放热”);
②对于气相反应,用某组分(B)的平衡分压(pB)代替平衡浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp的表达式为______________,提高![]() ,则Kp_____________(填“变大”、“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、
,则Kp_____________(填“变大”、“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、![]() =3~5,采用此条件的原因可能是___________。
=3~5,采用此条件的原因可能是___________。
【答案】CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=-162 kJ·mol-1 0.1125mol·L-1·min-1 ACD 吸热
CH4(g)+2H2O(g) △H=-162 kJ·mol-1 0.1125mol·L-1·min-1 ACD 吸热 ![]() 不变 催化剂的活性温度在400℃左右;且投料比
不变 催化剂的活性温度在400℃左右;且投料比![]() =3 ~5时,CO的平衡转化率较高,成本小
=3 ~5时,CO的平衡转化率较高,成本小
【解析】
(1)根据盖斯定律②+③-2×①可知CO2与H2反应生成CH4 和H2O(g)的热化学方程式CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H=-162 kJ·mol-1。故答案为:CO2(g)+4H2(g)
CH4(g)+2H2O(g)△H=-162 kJ·mol-1。故答案为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=-162 kJ·mol-1
CH4(g)+2H2O(g) △H=-162 kJ·mol-1
(2)①用CO2来生产燃料甲醇的化学方程式为CO2+3H2![]() CH3OH+H2O,从反应开始到平衡,H2的物质的量变化了2.25mol,则物质的量浓度变化2.25mol÷2L=1.125mol/L,反应在10min时达到平衡,v(H2)=1.125 mol/L÷10min=0.1125 mol·L-1·min-1。
CH3OH+H2O,从反应开始到平衡,H2的物质的量变化了2.25mol,则物质的量浓度变化2.25mol÷2L=1.125mol/L,反应在10min时达到平衡,v(H2)=1.125 mol/L÷10min=0.1125 mol·L-1·min-1。
②A.在原容器中再充入1molCO2将使CO2的转化率降低;在原容器中再充入1molH2,反应向正反应方向移动,会使CO2的转化率升高;在原容器中再充入1mol氦气,由于体积不变,所以浓度不变,因此对反应无影响;催化剂不能改变平衡状态,只能改变反应速率;缩小容器的容积可以增大压强,由于反应中反应物的化学计量数之和大于生成物,故反应会向正反应方向移动,使CO2的转化率升高;将水蒸气从体系中分离会使反应向正反应方向移动,使CO2的转化率升高;故选ACD。
(3)①从图中可以看到,随着反应温度升高,CO的平衡转化率降低,故正反应是放热反应,所以逆反应是吸热反应。
②用平衡分压(pB)代替平衡浓度(cB)表示平衡常数Kp=![]() 。提高
。提高![]() ,对Kp无影响,故Kp不变。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、
,对Kp无影响,故Kp不变。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、![]() =3~5,采用此条件的原因可能是:催化剂的活性温度在400℃左右;且投料比
=3~5,采用此条件的原因可能是:催化剂的活性温度在400℃左右;且投料比![]() =3 ~5时,CO的平衡转化率较高,成本小。
=3 ~5时,CO的平衡转化率较高,成本小。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量。如H-H键的键能是436kJ/mol,H—Cl键的键能是431kJ/mol,Cl—Cl键的键能是247 kJ /mol,H2和Cl2反应生成1molHCl放出的热量是( )
A.431kJB.179kJC.89.5kJD.以上说法都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相对分子质量为70的烯烃的分子式为________;若该烯烃与足量的H2加成后能生成含3个甲基的烷烃,则该烯烃可能的结构简式为____________。
(2)有机物A的结构简式为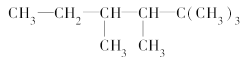
①若A是单烯烃与氢气加成后的产物,则该单烯烃可能有________种结构;
②若A是炔烃与氢气加成的产物,则此炔烃可能有________种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E(二乙酸-1,4-环己二醇酯)是一种制作建筑材料的原料。其合成路线如下:
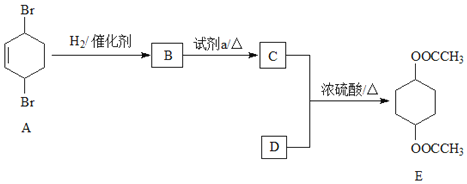
完成下列填空:
(1)A中含有的官能团是______;E的分子式是______;试剂a是______。
(2)写出反应类型:B→C______。
(3)C与D反应生成E的化学方程式:______。
(4)C的同分异构体,能使石蕊试剂显红色,写出该物质的一种结构简式______。
(5)设计一条以环己醇(![]() )为原料(其他无机试剂任取)合成A的合成路线。
)为原料(其他无机试剂任取)合成A的合成路线。
(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)_____________________
目标产物)_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加徳罗常数的值,下列说法正确的是
A.12g石墨烯(单层石墨)中含有六元环的个数为2NA
B.标准状况下,22.4LHF中含有的氟原子数目为NA
C.密闭容器中,lmolNH3和lmolHC1反应后气体分子总数为NA
D.在1L 0.1 mol/L的硫化钠溶液中,阴离子总数大于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)熔点-54.1℃,沸点在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。
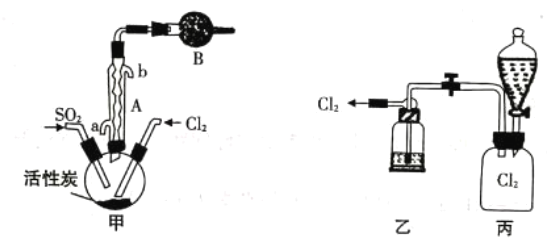
(1)SO2Cl2中的S的化合价为_______________,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为_______________。
(2)现拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯,实验装置如图所示(部分夹持装置未画出)。
①仪器A的名称为_______________,装置乙中装入的试剂是_______________,装罝B的作用是_______________。
②装置丙分液漏斗中盛装的最佳试剂是_______________(选填编号)。
A.蒸馏水 B.l0.0mol·L-1浓盐酸
C.浓氢氧化钠溶液 D.饱和食盐水
③滴定法测定硫酰氯的纯度:取1.800g产品,加入到100mL0.50000mol·L-1NaOH溶液中加热充分水解,冷却后加蒸馏水准确稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴甲基橙,用0.1000mol·L-1标准HC1滴定至终点,重复实验三次取平均值,消耗HCl l0.00mL。达到滴定终点的现象为_______________,产品的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式如图所示,下列关于苯佐卡因的叙述正确的是( )
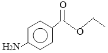
A. 分子中含有3种官能团
B. 1 mol该化合物最多与4 mol氢气发生加成反应
C. 苯环上有2个取代基,且含有硝基的同分异构体有15种
D. 分子式为C9H10NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H7Cl的有机物,其结构不可能是( )
A. 分子中只有一个双键
B. 分子中可能有两个双键
C. 分子中可能含有一个叁键
D. 分子中可能含有一个双键和一个环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。
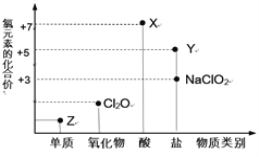
回答下列问题:
(1)X的电离方程式为_________。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n= _________。
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_____________。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的 ___________倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为_____________。
(6)自来水中的![]() 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中![]() 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原![]() ,产物是N2。发生的反应可表示如下,请完成方程式的配平:___Al+ ____
,产物是N2。发生的反应可表示如下,请完成方程式的配平:___Al+ ____![]() + _____=___
+ _____=___![]() + _____ N2↑ + _______H2O
+ _____ N2↑ + _______H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com