
【题目】常温下,向10 mL 1 mol/L HCl溶液中滴加等物质的量浓度的CH3COONa溶液。所得混合液的pH与加入CH3COONa溶液的体积(V)的变化如下图所示。下列说法不正确的是

A. 常温下,CH3COOH的电离常数约为2×10-5
B. 随着V的增加,混合液中水的电离程度先增加后减小
C. 当V=20mL时,混合液中c(Na+) >c(CH3COO-)> c(Cl-)>c(H+) >c(OH-)
D. 当混合液的pH=7时,混合液中c(CH3COOH)=c(Cl-)
【答案】B
【解析】A、当滴加的CH3COONa溶液体积为10 mL时,得到浓度均为0.5mol/L的CH3COOH和NaCl混合溶液,根据题中信息可知,此时溶液pH=2.5, c(CH3COO-)=c(H+)=10-2.5mol/L,c(CH3COOH)=0.5mol/L-10-2.5mol/L![]() 0.5mol/L,Ka=
0.5mol/L,Ka=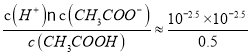 =2×10-5,选项A正确;B、酸和碱抑制水的电离,盐的水解促进水的电离,随着V的增加,混合溶液由盐酸转化为醋酸和氯化钠的混合溶液再到醋酸钠过量,混合液中水的电离程度逐渐增大,选项B不正确;C、当V=20mL时,混合液中以溶质为醋酸和醋酸钠按1:1形成的溶液,溶液呈酸性,说明醋酸的电离大于醋酸根离子的水解,c(Na+) =2 c(Cl-),2c(CH3COO-)>c(Na+),故有:c(Na+) >c(CH3COO-)> c(Cl-)>c(H+) >c(OH-),选项C正确;D、当混合液的PH=7时,①c(H+) =c(OH-),根据物料守恒有:②c(Na+) =c(CH3COO-)+ c(CH3COOH),根据电荷守恒有:③c(H+)+c(Na+) =c(CH3COO-)+ c(OH-) +c(Cl-),将①②式代入③式可得c(CH3COOH)=c(Cl-),选项D正确。答案选B。
=2×10-5,选项A正确;B、酸和碱抑制水的电离,盐的水解促进水的电离,随着V的增加,混合溶液由盐酸转化为醋酸和氯化钠的混合溶液再到醋酸钠过量,混合液中水的电离程度逐渐增大,选项B不正确;C、当V=20mL时,混合液中以溶质为醋酸和醋酸钠按1:1形成的溶液,溶液呈酸性,说明醋酸的电离大于醋酸根离子的水解,c(Na+) =2 c(Cl-),2c(CH3COO-)>c(Na+),故有:c(Na+) >c(CH3COO-)> c(Cl-)>c(H+) >c(OH-),选项C正确;D、当混合液的PH=7时,①c(H+) =c(OH-),根据物料守恒有:②c(Na+) =c(CH3COO-)+ c(CH3COOH),根据电荷守恒有:③c(H+)+c(Na+) =c(CH3COO-)+ c(OH-) +c(Cl-),将①②式代入③式可得c(CH3COOH)=c(Cl-),选项D正确。答案选B。


科目:高中化学 来源: 题型:
【题目】现有100mL1mol/L稀盐酸,欲将其浓度变为2mol/L,可以采取的措施为( )
A. 向其中通入标况下22.4LHCl气体 B. 加热蒸发使溶液体积变为50mL
C. 加热蒸发掉50mL水 D. 加入5mol/L盐酸100mL,再将溶液体积稀释到300mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四种不同情况下,可逆反应A(g)+2B(g)C(g)+D(g)的反应速率如下,其中反应进行得最快的是
A. v(A)=0.15 mol/(L·min) B. v(B)=0.6 mol/(L·min)
C. v(C)=0.4 mol/(L·min) D. v(D)=0.02 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体,判断不正确的是( )
A. 胶体的本质特征是胶体粒子直径在1nm~100nm
B. 煮沸饱和FeCl3溶液可以制得Fe(OH)3胶体
C. 丁达尔现象可以用来区别胶体和溶液
D. 溶液和胶体的分散质能通过滤纸孔隙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种离子化合物分别由Ba2+、NH4+、Na+、Mg2+中的一种和OH-、HSO4-、CO32-、Cl-中的一种组成。为确定其组成,某兴趣小组做了以下实验:
①配制浓度均为0.1mol/L的四种溶液,测其PH,其中B的PH大于13,C的PH大于7。
②将足量的B溶液与A溶液混合并微热,生成了白色沉淀与刺激性气味气体。
据此请回答下列问题:
(1)D的化学式为____,A在水中的电离方程式为____;
(2)A与B按物质的量之比2:1在水溶液中进行反应的离子方程式为___;
(3)已知CH3COONH4溶液呈中性,如将等浓度、等体积的A溶液滴加到C溶液中,所得混合液呈____性(填“酸”、“碱”、“中”),各离子浓度由大到小的顺序为____;
(4)将C和D的溶液分别蒸干并灼烧,所得固体分别是____。(填化学式)
(5)分别向含有0.15molB的溶液中加入100mL和200mL的A溶液并加热收集生成的气体,所得气体在标准状况下的体积均为VL,则V等于____,所加A溶液的物质的量浓度为____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按只含离子键、只含共价键、既含离子键又含共价键的顺序排列的是
A. 氯气 二氧化碳 氢氧化钠 B. 氯化钠 过氧化钠 氯化铵
C. 氯化钠 过氧化氢 氯化铵 D. 氯化钠 氦气 氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从硫化物中提取单质锑,经历以下两个过程:①2Sb2S3+3O2+6Fe![]() Sb4O6+6FeS ②Sb4O6+6C
Sb4O6+6FeS ②Sb4O6+6C![]() 4Sb+6CO↑,关于反应①、②的说法不正确的是( )
4Sb+6CO↑,关于反应①、②的说法不正确的是( )
A. 反应①中锑元素被氧化
B. 反应②中锑元素被还原
C. 标准状况下,每生成4 mol Sb时,消耗67.2 L O2
D. 反应②说明高温下C的还原性比Sb强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g)2NH3(g)
△H<0达到平衡的标志是(填编号)
①反应速率v(N2):v(H2):v(NH3)=1:3:2
②各组分的物质的量浓度不再改变
③体系的压强不再发生变化
④混合气体的密度不变
⑤单位时间内生成n mol N2的同时,生成3n mol H2
⑥2V(N2正)=V(NH3逆)
⑦单位时间内3mol H﹣H键断裂的同时2mol N﹣H键也断裂
⑧混合气体的平均相对分子质量不再改变
(2)现有八种物质:①干冰;②金刚石;③四氯化碳;④晶体硅;⑤过氧化钠;⑥碳化硅晶体;⑦溴化钠;⑧氖.请用编号填写下列空白:
A.属于原子晶体的是 , 其中熔点由高到低的顺序为
B.属于分子晶体的是 , 其中分子构型为正四面体的化合物的电子式为
C.既含有共价键又含有离子键的化合物是 , 其中阳离子个数与阴离子个数之比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com