
| A. | 浓硫酸与稀NaOH溶液反应的中和热为57.3 kJ•mol-1 | |
| B. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量为57.3 kJ | |
| C. | 若碳的燃烧热用△H3来表示,则△H3<△H1 | |
| D. | 若碳的燃烧热用△H3来表示,则△H3>△H1 |
分析 A、浓硫酸溶解放热;
B、醋酸是弱酸存在电离平衡,电离过程是吸热过程分析;
C、依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物反应放出的热量分析判断;
D、依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物反应放出的热量分析判断.
解答 解:A、浓硫酸溶解放热,所以浓硫酸与稀NaOH溶液反应放出的热量大于57.3 kJ/mol,故A错误;
B、醋酸是弱电解质,电离需吸收热量,稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3 kJ,故B错误;
C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物反应放出的热量,所以C燃烧应该生成二氧化碳,则放出热量大于110.5kJ,则△H3<△H1,故C正确;
D、燃烧热是1mol可燃物完全燃烧生成稳定氧化物反应放出的热量,所以C燃烧应该生成二氧化碳,则放出热量大于110.5kJ,则△H3<△H1,故D错误;
故选C.
点评 本题考查学生对于反应热、中和热的理解及有关计算等,难度不大,注意稀的强酸、强碱的中和热为△H=-57.3kJ/mol.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用分液漏斗前不用检查活塞处是否漏水 | |
| B. | 放气时,直接打开上口玻璃塞 | |
| C. | 分液操作时,下层液体从下端放出,上层液体从上口倒出 | |
| D. | 应选用球形分液漏斗进行分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑦ | B. | ①②④⑤ | C. | ③⑦ | D. | ③⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实 验 顺 序 | 实 验 内 容 | 实 验 现 象 |
| ① | A+B | 没有现象 |
| ② | B+D | 有气体放出 |
| ③ | B+C | 有沉淀生成 |
| ④ | A+D | 有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.配制0.10mol•L-1溶液 | B.除去CO中的CO2 | C.苯萃取碘水中I2,分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 | 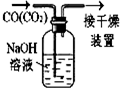 |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,请写出电解反应方程式2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;在电解过程中阳极(填“阴”或“阳”)需要定期补充.
;工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,请写出电解反应方程式2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;在电解过程中阳极(填“阴”或“阳”)需要定期补充.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向豆浆中加入盐卤做豆腐 | |
| B. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| C. | 高压除尘 | |
| D. | 黄河入海口处容易形成三角洲 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com