
已知反应2A(g)+B(g) C(g)+3D(g)的逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
C(g)+3D(g)的逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
A.ΔH<0,ΔS>0 B.ΔH<0,ΔS<0
C.ΔH>0,ΔS>0 D.ΔH>0,ΔS<0
科目:高中化学 来源: 题型:
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
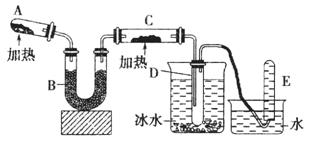
回答下列问题:
(1)A中生成氨气反应的化学方程式是_________________________________________;
(2)B中加入的干燥剂是_________(填序号)①浓硫酸②无水氯化钙 ③碱石灰;
(3)能证明氨与氧化铜反应的现象①C中______________、②D中有无色液体生成;
设计实验检验D中无色液的成分:取少量液体于试管中,加入少量________粉末,现象为___________________。
(4)写出氨气与氧化铜反应的化学方程式___________________________;若收集到2.24L(STP)氮气,计算转移电子数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-—→Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池的反应相同
A.①② B.②③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-====Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-====Ni2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
煤燃烧的反应热可通过以下两个途径来利用:
a.利用煤在充足的空气中直接燃烧产生的反应热;
b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为
a.C(s)+O2(g)====CO2(g) ΔH=E1 ①
b.C(s)+H2O(g)====CO(g)+H2(g) ΔH=E2 ②
H2(g)+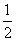 O2(g)====H2O(g) ΔH=E3 ③
O2(g)====H2O(g) ΔH=E3 ③
CO(g)+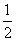 O2(g)====CO2(g) ΔH=E4 ④
O2(g)====CO2(g) ΔH=E4 ④
回答下列问题:
(1)与途径a相比途径b有较多的优点,即____________________________。
(2)上述四个热化学方程式中的反应__________________中ΔH>0。
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是____________。
A.a比b多 B.a比b少 C.a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
高温下,某反应达到平衡,平衡常数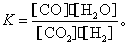 恒容时,温度升高,H2浓度减小。下列说法正确的是( )
恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为 CO+H2O CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在固定容积的密闭容器中,反应A(g)+3B(g) 2C
2C (g)达到平衡,测得平衡时A、B、C物质的量之比为1∶1∶2,若保持温度不变,以1∶1∶2的物质的量之比再充入A、B和C,下列判断正确的是( )
(g)达到平衡,测得平衡时A、B、C物质的量之比为1∶1∶2,若保持温度不变,以1∶1∶2的物质的量之比再充入A、B和C,下列判断正确的是( )
A.平衡不移动
B.平衡向逆反应方向移动
C.再次达到平衡时各物质的浓度都比原平衡时大
D.C的质量分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
某酸式盐NaHY的水溶液显碱性,下列叙述正确的是
( )
A.H2Y的电离方程式:H2Y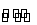 2H++Y2-
2H++Y2-
B.HY-的水解方程式:HY-+H2O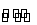 H3O++Y2-
H3O++Y2-
C.该酸式盐溶液中离子浓度关系:[Na+]>[HY-]>[OH-]>[H+]
D.该酸式盐溶液中离子浓度关系:[Na+]>[Y2-]>[HY-]>[OH-]>[H+]
查看答案和解析>>
科目:高中化学 来源: 题型:
为了探究温度、硫酸铜对锌与稀硫酸反应速率的影响规律,某同学设计如下方案:
| 编号 | 纯锌粉质量 | 0.2 mol·L-1硫酸体积 | 温度 | 硫酸铜固体质量 |
| Ⅰ | 2.0 g | 10.0 mL | 25℃ | 0 |
| Ⅱ | 2.0 g | 10.0 mL | t℃ | 0 |
| Ⅲ | 2.0 g | 10.0 mL | 35℃ | 0.2 g |
| Ⅳ | 2.0 g | 10.0 mL | 35℃ | 4.0 g |
下列推断合理的是( )
A.为了选择Ⅱ和Ⅲ实验探究硫酸铜对反应速率的影响,必须控制t=25
B.待测物理量是收集等体积(相同条件)气体所需要的时间,时间越长,反应越快
C.根据该方案,还可以探究硫酸浓度对反应速率的影响
D.根据该实验方案得出反应速率大小可能是Ⅲ>Ⅱ>Ⅰ>Ⅳ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com