
分析 (1)碱式碳酸铜的化学式为Cu2(OH)2CO3,可以把它看作由Cu(OH)2和CuCO3组成的物质,可根据氢氧化铜与稀盐酸反应、碳酸铜与稀盐酸反应书写;可溶性的重金属盐能使蛋白质变性;
(2)Cu2(OH)2CO3可写为Cu2(OH)2•CuCO3,氢氧化铜受热能分解生成氧化铜、水,CuCO3受热能分解生成氧化铜和二氧化碳,所以铜绿受热能分解生成氧化铜、水和二氧化碳,Cu2(OH)2CO3与CO高温反应生成铜和二氧化碳和水;
(3)发生的反应为Cu2(OH)2CO3+2CO$\frac{\underline{\;高温\;}}{\;}$2Cu+H2O+3CO2和 CO2+Ca(OH)2═CaCO3↓+H2O,根据反应的方程式可以找出Cu2(OH)2CO3、CO2和碳酸钙之间的关系,利用关系式法计算.
解答 解:氢氧化铜与稀盐酸反应生成氯化铜和水.该反应的化学方程式为:Cu(OH)2+2HCl=CuCl2+2H2O.碳酸铜与稀盐酸反应生成氯化铜、水和二氧化碳.该反应的化学方程式为:CuCO3+2HCl=CuCl2+CO2↑+H2O.碱式碳酸铜与稀盐酸反应的总化学方程式为:Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O,不慎摄入铜盐,铜盐离子为重金属离子能使蛋白质发生变性中毒,
故答案为:Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O;铜盐离子能使蛋白质发生变性使人体中毒;
(2)Cu2(OH)2CO3可写为Cu2(OH)2•CuCO3,氢氧化铜受热能分解生成氧化铜、水,CuCO3受热能分解生成氧化铜和二氧化碳,所以铜绿受热能分解生成氧化铜、水和二氧化碳,化学方程式为:Cu2(OH)2CO3$\frac{\underline{\;高温\;}}{\;}$2CuO+H2O+CO2↑,Cu2(OH)2CO3与CO高温反应,生成铜和二氧化碳和水,化学方程式为:Cu2(OH)2CO3+2CO$\frac{\underline{\;高温\;}}{\;}$2Cu+H2O+3CO2,
故答案为:Cu2(OH)2CO3$\frac{\underline{\;高温\;}}{\;}$2CuO+H2O+CO2↑;Cu2(OH)2CO3+2CO$\frac{\underline{\;高温\;}}{\;}$2Cu+H2O+3CO2;
(3)由发生的反应:Cu2(OH)2CO3+2CO$\frac{\underline{\;高温\;}}{\;}$2Cu+H2O+3CO2和 CO2+Ca(OH)2═CaCO3↓+H2O,可以得出Cu2(OH)2CO3、CO2和碳酸钙之间的关系是:Cu2(OH)2CO3~3CO2~3CaCO3.bg白色CaCO3沉淀,需Cu2(OH)2CO3的物质的量为$\frac{bg}{100g/mol}$×$\frac{1}{3}$,则Cu2(OH)2CO3的纯度为$\frac{bg}{\frac{100g/mol}{ag}}×\frac{1}{3}×221g/mol$=$\frac{221ab}{300}$×100%,
故答案为:$\frac{221ab}{300}$×100%.
点评 本题考查了铜绿的有关知识,掌握氧化铜、氢氧化铜的性质是解答关键,(3)注意利用关系式法简化计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 燃煤时鼓入过量的空气可以减少酸雨的产生 | |
| B. | 利用汽车尾气催化装置可将尾气中的NO和CO转化为无害气体 | |
| C. | “煤改气”、“煤改电”等工程有利于减少雾霾 | |
| D. | 工业废气排放之前必须回收处理以防污染大气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:H2(g)+F2(g)═2HF(g)△H=-546.6 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2mol 液态氟化氢放出的热量小于546.6 kJ | |
| B. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g) 置于密闭容器中充分反应生成NH3(g)放热19.3 kJ.其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则H2SO4(aq)+Ca(OH)2(aq)═CaSO4(s)+2H2O(l)△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
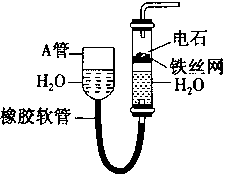 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法计算 | B. | 2.8g | C. | 5.6g | D. | 11.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
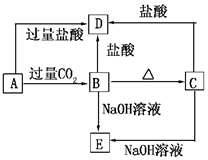 A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃).
A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4比CH4稳定 | |
| B. | P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | O2-半径比F-的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com