
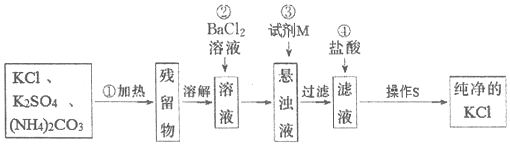
分析 实验室用含K2SO4、(NH4)2CO3杂质的KCl,制纯净的KCl固体,步骤①先对固体进行加热,使碳酸铵分解,残留固体中含有K2SO4、KCl,将固体溶解得溶液,步骤②在溶液中加入过量的氯化钡将硫酸根离子沉淀而除去,步骤③再加过量的碳酸钾溶液使过量的钡离子沉淀,所以试剂M为K2CO3溶液,过滤得滤液中含有氯化钾和碳酸钾,步骤④加入过量的盐酸使溶液中碳酸钾生成氯化钾,将所得溶液蒸发结晶可得氯化钾晶体,多余的氯化氢会挥发而除去,所以操作S为蒸发结晶,据此答题.
解答 解:(1)根据上面的分析可知,步骤①加热的目的是使碳酸铵分解,除去(NH4)2CO3杂质,加热固体可以在坩埚中进行,
故答案为:除去(NH4)2CO3杂质;坩埚;
(2)步骤②如果用硝酸钡溶液,则在溶液中引入硝酸根离子杂质,所以不能用,
故答案为:溶液中引入新的杂质离子NO3-;
(3)进行步骤②时,简述判断SO42-是否除尽的实验操作、现象和结论是取(或继续向)上层清液中滴加BaCl2溶液,若无白色沉淀产生,说明SO42-已除尽,
故答案为:取(或继续向)上层清液中滴加BaCl2溶液,若无白色沉淀产生,说明SO42-已除尽;
(4)根据上面的分析可知,步骤③所加试剂M为K2CO3溶液,其目的是除去步骤②引入的过量Ba2+,
故答案为:K2CO3溶液;除去步骤②引入的过量Ba2+;
(5)根据上面的分析可知,操作S的名称是蒸发结晶,
故答案为:蒸发结晶.
点评 本题考查了中学常见物质分离和提纯的基本操作的掌握,侧重于学生的分析和实验能力的考查,注意把握物质的性质的异同,考虑实验设计的严密性,题目难度中等.


科目:高中化学 来源: 题型:推断题
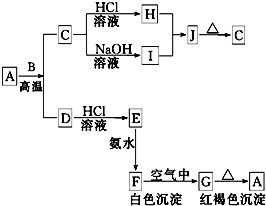 A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
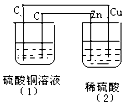 如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上通过了0.02mole-.若不考虑溶液体积的变化,下列叙述正确的( )
如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上通过了0.02mole-.若不考虑溶液体积的变化,下列叙述正确的( )| A. | 相同条件下,两容器产生的气体体积相同 | |
| B. | (1)、(2)溶液的pH值均减小 | |
| C. | (1)中阳极电极反应方程式为:4OH--4e-═2H2O+O2↑ | |
| D. | (2)中正极反应为Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O中含NA个质子 | |
| B. | 1 L 1 mol•L-1的CuSO4溶液中含NA个Cu2+ | |
| C. | 常温常压下,2.24 L Cl2中含0.2NA个氯原子 | |
| D. | 0.5 mol Al与足量NaOH溶液充分反应,转移的电子数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:M>Z>Y>X | |
| B. | 气态氢化物:X<Z | |
| C. | X的氧化物一定是非极性分子 | |
| D. | Y单质可用于航空航天合金材料的制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 半反应式 | Fe2+表现的性质 | 完成该半反应式选用的物质 |
| A | Fe2++2e-═Fe | 氧化性 | I- |
| B | Fe2++2e-═Fe | 还原性 | Al |
| C | Fe2+-e-═Fe3+ | 氧化性 | Fe |
| D | Fe2+-e-═Fe3+ | 还原性 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
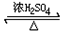 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨的形成CO2+H2O═H2CO3化合反应 | |
| B. | 干粉灭火器的反应原理6NaHCO3+2Al2(SO4)3═3Na2SO4+6CO2↑+Al(OH)3↓复分解反应 | |
| C. | 用稀硫酸洗去附着在试管壁上的铜Cu+H2SO4═CuSO4+H2↑ 置换反应 | |
| D. | 误服用氯化钡后用硫酸镁解毒BaCl2+MgSO4═MgCl2+BaSO4↓ 复分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com