
下列叙述正确的是
A.将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色
B.将一小块钠放入盛有水的烧杯中,钠在水面上游动,同时看到烧杯内的溶液变为红色
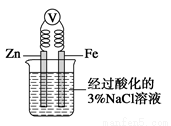
C.如图,一段时间后给烧杯内的溶液中加入氢氧化钠溶液,可看到Fe电极附近有红褐色沉淀生成
D.向盛有少量Mg(OH)2沉淀悬浊液的试管中滴加氯化铵溶液,可看到沉淀溶解
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源:2017届福建省高三上学期第二次月考化学试卷(解析版) 题型:选择题
某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等七种离子中的几种。现取该溶液进行实验,得到如下实验现象:①向溶液中滴加足量氯水后,溶液变橙黄色,且有无色无味气体产生;②向所得橙黄色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此可以推断,该溶液中肯定不存在的离子是
A.Al3+、Mg2+、SO32-、I- B.Mg2+、Na+、CO32-、I-
C.Al3+、Na+、SO32-、I- D.Al3+、CO32-、Br-、SO32-
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中实验班高一12月考化学卷(解析版) 题型:填空题
(1)向某 NaOH 溶液中投入一块 Al箔,先无明显现象,随后逐渐产生气泡,则产生气泡的离子反应方程式为_________________________。
(2)实验室常用还原性 Fe 粉与水蒸气反应的实验来研究 Fe 的还原性,则该反应的化学反应方程式为_________________________。
(3)Fe(OH)2 制备时,采用的方法是“长滴管、液面下”的实验操作,但在实验时,由于操作不当,依旧会出现白色沉淀、灰绿色沉淀直至最终变为红褐色沉淀,写出白色沉淀最终转化为红褐色沉淀的化学反应方程式为________________________。
(4)实验时制备 Al(OH)3 时,常用可溶性铝盐(如 Al2(SO)4)与氨水反应进行制备。某课外小组在实验时不慎向 Al2(SO)4 溶液中加入了过量 NaOH 溶液,最终并没有制出白色沉淀 Al(OH)3,则该小组同学实验时发生的总离子反应方程式为______________________。
(5)充分煅烧 CoC2O4 后可得到 2.41g 钴的氧化物和 1.344L(标准状况)CO2 气体,则生成钴的氧化物的化学式为________________,煅烧 CoC2O4 的化学反应方程式为____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中实验班高一12月考化学卷(解析版) 题型:选择题
NA 为阿伏加德罗常数,下列说法不正确的是( )
A. 58.5 克 NaCl 中,Na+最外层电子数为 8NA
B. Na2O、Na2O2 中阴阳离子个数均为 1:2
C. 标准状况下11.2升Cl2 与足量Fe充分反应转移NA个电子
D. 2.7克Al分别与足量稀盐酸和足量NaOH溶液反应,生成氢气质量不相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:填空题
(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

①写出电极反应式:正极___________________;负极_________________。
②图中X溶液是________,Y溶液是________。
③原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。
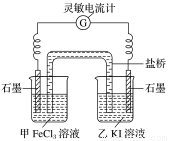
(2)控制适合的条件,将反应2Fe3++2I- 2Fe2++I2,设计成如图所示的原电池。
2Fe2++I2,设计成如图所示的原电池。
请回答下列问题:
反应开始时,乙中石墨电极上发生____________(填“氧化”或“还原”)反应,电极反应式为________________。甲中石墨电极上发生______________反应,电极反应式为___________。
②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作___________(填“正”或“负”)极,该电极的电极反应式为____________________。
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为_____________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
根据下图海水综合利用的工业流程图,判断下列说法正确的是( )
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
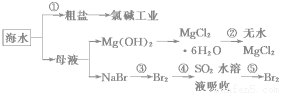
A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D.从第③步到第⑤步的目的是为了制取并提纯Br2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
对处于平衡状态的反应2A(g)+B(g) 2C(g) ΔH<0,下列叙述正确的是 (
2C(g) ΔH<0,下列叙述正确的是 (  )
)
A.升高温度,v正减小,v逆增大 B.增大A浓度的瞬间,v正增大,v逆不变
C.增大压强,v正增大,v逆减小 D.加入正催化剂,v正增大,v逆减小
查看答案和解析>>
科目:高中化学 来源:2017届安徽马鞍山二中安师大附中高三12月联考化学卷(解析版) 题型:选择题
下列实验方案的设计、结论正确的是( )
A.用NaHCO3溶液可一次鉴别出稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2溶液
B.高锰酸钾试剂瓶内壁上黑色物质可用稀盐酸洗涤( )
C.除去SO2中少量HCl,将其通入饱和的Na2SO3溶液
D.将硝酸铵晶体溶于水,测得水温下降,证明硝酸铵水解是吸热的
查看答案和解析>>
科目:高中化学 来源:2017届广东省七校联合体高三上学期第二次联考化学试卷(解析版) 题型:填空题
汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染。
(1)已知:
①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
③CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) △H3= 。
N2(g)+CO2(g)+2H2O(g) △H3= 。
(2)反应③在热力学上趋势很大,其原因是 。在固定容器中按一定比例混合CH4与NO2后,提高NO2转化率的反应条件是 。
(3)在130℃和180℃时,分别将0.50mol CH4和a mol NO2充入1L的密闭容器中发生反应③,测得有关数据如下表:
实验编号 | 温度 | 0分钟 | 10分钟 | 20分钟 | 40分钟 | 50分钟 | |
1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
① 开展实验1和实验2的目的是 。
② 130℃时,反应到20分钟时,NO2的反应速率是 。
③ 180℃时达到平衡状态时,CH4的平衡转化率为 。
④ 已知130℃时该反应的化学平衡常数为6.4,试计算a= 。
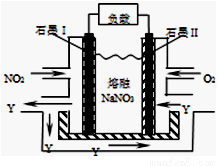
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图。该电池在使用过程中石墨I电极上生成氧化物Y,该电极反应为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com