
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.增大体系压强,活化分子数增加,化学反应速率一定增大 |
| B.加入反应物,使活化分子百分数增加,化学反应速率增大 |
| C.活化分子间所发生的分子间的碰撞均为有效碰撞 |
| D.升高温度,活化分子百分数增加,化学反应速率一定增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 试管 | 温度 | 过氧化氢浓度 | 催化剂 |
| a | 室温(25℃) | 12% | 有 |
| b | 水浴加热(50℃) | 4% | 无 |
| c | 水浴加热(50℃) | 12% | 有 |
| d | 室温(25℃) | 4% | 无 |
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.大于25.3% | B.小于25.3% | C.等于25.3% | D.约等于25.3% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3COOCH2CH3+H2O,下列说法错误的是
CH3COOCH2CH3+H2O,下列说法错误的是| A.使用催化剂可以加快反应速率 | B.升高温度可以加快反应速率 |
| C.使用过量乙醇能使乙酸完全转化为乙酸乙酯 | D.该反应属于取代反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入适量FeCl3溶液 | B.加入适量KNO3溶液 |
| C.加入适量的K2CO3溶液 | D.加入适量Na2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2Z(g);△H<0若达到平衡时气体总物质的量变为原来的0.85倍。请回答下列问题。
2Z(g);△H<0若达到平衡时气体总物质的量变为原来的0.85倍。请回答下列问题。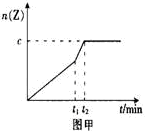
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com