
| 滴定次数 | 待测NaOH 溶液的体积来 | 0.1000mol/L盐酸的体积/mL[学+ | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.28 | 26.28 |
| 第二次 | 25.00 | 1.55 | 30.30 | 28.75 |
| 第三次 | 25.00 | 0.20 | 26.42 | 26.22 |
| c(标准)×c(标准) |
| V(待测) |
| c(标准)×c(标准) |
| V(待测) |
| c(标准)×c(标准) |
| V(待测) |
| c(标准)×c(标准) |
| V(待测) |
| c(标准)×c(标准) |
| V(待测) |
| c(标准)×c(标准) |
| V(待测) |
| c(标准)×c(标准) |
| V(待测) |
| 0.1000×0.02625 |
| 0.025 |


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度 (mol?L-1) | 0.00l0 | 0.0100 | 0.0200 | 0.1000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.甲同学认为两者反应只生成CuCO3一种沉淀;乙同学认为这两者相互促进水解,只生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.甲同学认为两者反应只生成CuCO3一种沉淀;乙同学认为这两者相互促进水解,只生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)查看答案和解析>>
科目:高中化学 来源: 题型:

 ,所以它属于二肽
,所以它属于二肽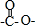 结构且能发生银镜反应 ②N原子直接与苯环相连③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3,
结构且能发生银镜反应 ②N原子直接与苯环相连③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3,查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定前 | 第一次 终点 | 第二次 终点 | 第三次 终点 | |
| 碱式滴定管 液面刻度 | 0.10mL | 19.12mL | 18.15mL | 19.08mL |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、托盘天平、烧杯、容量瓶、玻璃棒 |
| B、烧杯、玻璃棒、胶头滴管、量筒 |
| C、烧杯、500mL容量瓶、玻璃棒、胶头滴管 |
| D、烧杯、500mL容量瓶、玻璃棒、胶头滴管、量筒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com