
科目:高中化学 来源: 题型:解答题
| Fe2+ | Fe3+ | Cu2+ | |
| 开始沉淀时pH | |||
| 完全沉淀时pH | 8 | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离产生的c(H+)=1×10-12 mol•L-1的溶液中:K+、Na+、Fe2+、NO3- | |
| B. | 室温下,pH=7的溶液中:Al3+、Cl-、HCO3-、SO42- | |
| C. | 加酚酞呈红色的溶液中:CO32-、Cl-、F-、NH4+ | |
| D. | c(H+)/c(OH-)=1012的溶液中:NH4+、NO3-、Cl-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL2mol/LMgCl2溶液 | B. | 1000mL2.5mol/LNaCl溶液 | ||
| C. | 300mL5mol/LFeCl3溶液 | D. | 250mL lmol/L AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
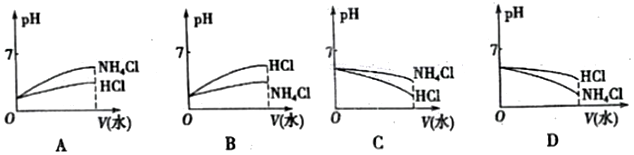
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加入足量锌片,两种溶液生成H2的体积相同 | |
| B. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| C. | 醋酸中的c(CH3COO-)和硫酸中的c(SO${\;}_{4}^{2-}$)相等 | |
| D. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用工业盐(NaNO2)作咸味调味品 | |
| B. | 用硫磺熏制银耳,使它颜色更白 | |
| C. | 食盐中加入一定量的碘酸钾(KIO3)制取加碘食盐 | |
| D. | 将含有甲醇(CH3OH)的工业酒精兑制成饮用白酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ/mol. 在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ/mol. 在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
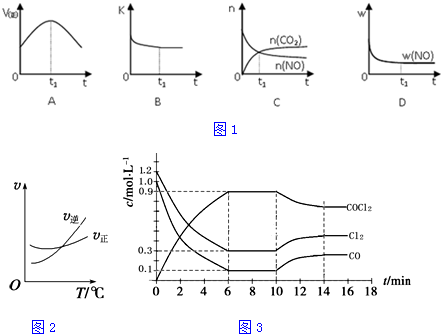
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com