
【题目】25℃时,用 0.1molL-1NaOH溶液滴定 20 mL 0.1 molL-1 某二元弱酸 H2A ( Ka1 =1.1×10-3,Ka2= 3.9×10-6 )溶液,滴定过程中溶液的 pH 变化曲线如图所示。下列说法正确的是
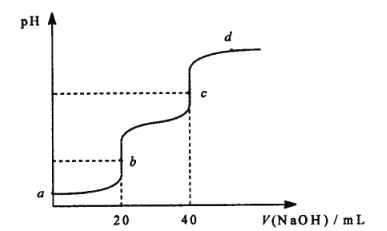
A.a 点的pH 大于2
B.b 点溶液中c(H2A) > c(A2-)
C.c 点溶液中c( HA-) + 2c(H2A ) = c( OH- )-c(H+)
D.d 点溶液中c (Na+) +c(H+) =c(A2-) +c(HA-) +c(OH-)
【答案】C
【解析】
A. a 点发生H2A的电离且Ka1>>Ka2,故Ka1=c(HA)×c(H+)/c(H2A)=1.1×10-3,则c2(H+)=1.1×10-3×0.1,解得c(H+)≈1.05×10-2,故pH小于2,A项错误;
B. b点酸碱恰好完全反应生成NaHA,溶液显酸性,溶液中电荷守恒c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),物料守恒c(Na+)=c(HA-)+c(A2-)+c(H2A),得到:c(H2A)+c(H+)=c(A2-)+c(OH-),则c(H2A)<c(A2-),B项错误;
C. c点为Na2A,溶液显碱性,溶液中电荷守恒c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),物料守恒c(Na+)=2c(HA-)+2c(A2-)+2c(H2A),得到:c(HA-)+2c(H2A )=c(OH- )-c(H+),C项正确;
D. d点为Na2A和NaOH的混合物,溶液显碱性,溶液中电荷守恒c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】为充分利用资源,变废为宝,实验室里利用废铁屑制取硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]。某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。

已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。请回答下列问题:
(1)步骤②中,H2C2O4稍过量的主要原因是________。
(2)为了提高步骤③得到的FeC2O4·2H2O的纯度,宜用________(填“热水”“冷水”或“无水乙醇”)洗涤,检验洗涤是否干净的操作是________。
(3)实现步骤④必须用到的两种仪器是________(供选仪器:a. 烧杯;b. 坩埚;c. 蒸馏烧瓶;d. 高温炉;e. 表面皿;f. 锥形瓶)。
(4)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是________。
(5)硫酸亚铁铵是重要的工业原料,其溶解性如表所示:
10 | 20 | 30 | 40 | 50 | 60 | |
(NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO4·7H2O | 40.0 | 48.0 | 60.0 | 73.3 | — | — |
(NH4)2Fe(SO4)2·6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
(注意:高于73.3℃,FeSO4·7H2O发生分解)
以铁屑(有油污)、硫酸、硫酸铵为原料,补充制取硫酸亚铁铵晶体的实验方案:将铁屑置于锥形瓶中,______,冷却,过滤,用蒸馏水洗涤铁屑至中性,将铁屑置于锥形瓶中,_____至铁屑完全溶解,_____,冷却结晶,用无水乙醇洗涤2~3次,低温干燥。[实验中必须使用的试剂:铁屑、1.0 mol·L-1的Na2CO3溶液、3.0 mol·L-1的H2SO4溶液,饱和(NH4)2SO4溶液]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H5IO6(正高碘酸)是用于光度法测定苯肼的试剂。工业上用NaIO3制备H5IO6的流程如图:
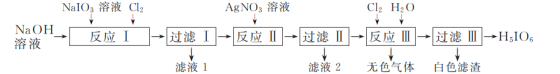
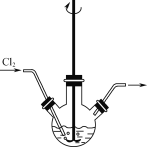
(1)“反应Ⅰ”可在如图所示的装置中进行。该反应生成不溶于水的Na2H3IO6的离子方程式为____。若要提高Cl2的利用率,可对装置进行改进的措施为___。
(2)反应Ⅱ生成不溶于水的黑色Ag5IO6,“滤液2”呈__(填“酸”“碱”或“中”)性。
(3)“无色气体”为__(填化学式)。
(4)工业上为降低成本,减少对环境的污染,整个流程需要控制加入Cl2和AgNO3的物质的量之比为n(Cl2)∶n(AgNO3)=__。
(5)H5IO6具有强氧化性,可将FeSO4氧化为H2FeO4,自身被还原为HIO3,该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取含硝基的炸药等。试回答下列问题:
(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:
①写出铁与过量稀硝酸反应的离子方程式:__。
②写出过量铁与稀硝酸反应的离子方程式:__。
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为__。上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为__g。
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:__Al+__NO3-+__OH-+__=__[Al(OH)4]-+__N2↑。
②上述反应中,还原剂与还原产物的物质的量之比是__,反应中转移电子0.3mol,生成__mL(标准状况下)N2。
【答案】Fe+NO3-+4H+=Fe3++NO↑+2H2O 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O 2∶3 40 10 6 4 18H2O 10 3 10∶3 672
【解析】
(1)①铁与过量稀硝酸反应生成硝酸铁、NO和水,离子方程式为Fe+NO3-+4H+=Fe3++NO↑+2H2O;
②过量铁与稀硝酸反应生成硝酸亚铁、NO和水,离子方程式为3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O;
③28g铁的物质的量为0.5mol,与含1.6mol硝酸的稀硝酸恰好完全反应,设生成的Fe3+和Fe2+的物质的量分别是xmol、ymol,即生成xmol硝酸铁和ymol硝酸亚铁,根据N原子守恒知,生成NO的物质的量为(1.6-3x-2y)mol,根据得失电子守恒有3x+2y=3(1.6-3x-2y),又有x+y=0.5,解得x=0.2,y=0.3,则生成的Fe3+和Fe2+的物质的量之比为2∶3;上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,由于生成的氢氧化亚铁在空气中易被氧化为氢氧化铁,氢氧化铁受热分解最终得到的固体是氧化铁,故其物质的量为0.5mol×![]() =0.25mol,质量为40g;
=0.25mol,质量为40g;
(2)①根据得失电子守恒、原子守恒及电荷守恒,可知离子方程式为10Al+6NO3-+4OH-+18H2O=10[Al(OH)4]-+3N2↑;
②上述反应中,还原剂是Al,还原产物是N2,其物质的量之比为10∶3;由方程式可知,生成3molN2时转移电子30mol,所以反应中转移电子0.3mol,生成N2的体积(标准状况下)为![]() ×22.4L·mol-1=0.672L=672mL。
×22.4L·mol-1=0.672L=672mL。
【点睛】
金属与硝酸反应的计算一般常采用以下方法:①原子守恒法:HNO3与金属反应时,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量;②得失电子守恒法:HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得到电子的物质的量等于金属失电子的物质的量;③电荷守恒法:HNO3过量时反应后溶液中(不考虑OH-)有:c(NO3-)=c(H+)+nc(Mn+)(Mn+代表金属离子);④离子方程式计算法:金属与H2SO4、HNO3的混合酸反应时,由于溶液中NO3-在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO3-进行相关计算,且溶液中要符合电荷守恒。
【题型】综合题
【结束】
21
【题目】如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:

(1)写出N2的一种用途:___。
(2)HNO3与图中的物质C
(3)实验室制取物质B的化学方程式为____。
(4)NO2与水反应生成物质A的化学方程式为____。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(11分)有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。已知:
①B分子中没有支链。
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有 (选填序号)
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D、F分子所含的官能团的名称依次是: 、 。
(3)写出与D、E具有相同官能团的同分异构体的可能结构简式:
。
(4)E可用于生产氨苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道,可由2—甲基—1—丙醇和甲酸在一定条件下制取E。该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作对应的现象不符合事实的是
|
|
|
|
A.用铂丝蘸取NaCl溶液置于酒精灯火焰上灼烧,火焰呈黄色 | B.将少量银氨溶液加入盛有淀粉和硫酸的试管中,加热,产生光亮的银镜 | C.饱和食盐水通电一段时间后,湿润的KI-淀粉试纸遇b处气体变蓝色 | D.将胆矾晶体悬挂于盛有浓H2SO4的密闭试管中,蓝色晶体逐渐变为白色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙和铜合金可用作电解制钙的阴极电极材料,回答下列问题:
(1)基态铜原子的价电子排布式为_________________。
(2)CaCO3高温分解可制得CaO。CaO与 C 在一定条件下可生成CaC2,CaC2与水反应生成 Ca(OH)2和一种 4 原子气体分子。
①CaCO3中阴离子的空间构型为______________。
②该气体分子中 σ 键与π键的数目之比为_____________。
③写出 2 种与 ![]() 互为等电子体的分子的化学式______________。
互为等电子体的分子的化学式______________。
(3)工业上电解 CaCl2制Ca而不采用电解 CaO 的原因是_______________。
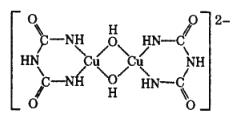
(4)在碱性溶液中,缩二脲 HN( CONH2)2与 CuSO4反应得到一种特征紫色物质,其结构如图所示,该反应原理可用于检验蛋白质或其他含键的化合物。缩二脲分子中碳原子与氮原子的杂化类型分别为__________、________。
(5)一种钙铜合金的结构可看作图a、b 两种原子层交替堆积排列而成c,其晶胞如图d。
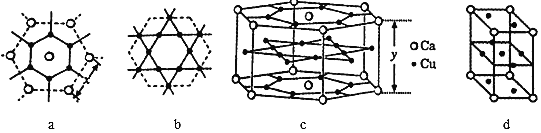
①a图Ca-Ca 间距离为x pm,c图中Ca-Ca间距离为y pm。已知原子拥有的尽可能多的相邻原子的个数叫该原子的配位数,则晶胞c中Ca原子的配位数(Cu原子)为_______。
②设阿伏加德罗常数的值为 NA,则该钙铜合金的密度是_______gcm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家开发出一种低成本光伏材料—蜂窝状石墨烯。生产原理是Na2O+2CO  Na2CO3+C(石墨烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是( )
Na2CO3+C(石墨烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是( )
A.该生产石墨烯的反应属于氧化还原反应
B.石墨烯与金刚石互为同素异形体
C.Na2O属于碱性氧化物,CO属于酸性氧化物,Na2CO3属于盐
D.自然界中钠元素以化合态形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。

已知:lg X=lg c(CO32-)/c(HCO3-)或lg c(HCO3-)/c(H2CO3),下列叙述正确的是( )
A. 曲线m表示pH与c(HCO3-)/c(H2CO3)的变化关系
B. 当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C. Ka1(H2CO3)=1.0×10-6.4
D. 25 ℃时,CO32-+H2O![]() HCO3-+OH-的平衡常数为1.0×10-7.6
HCO3-+OH-的平衡常数为1.0×10-7.6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com