
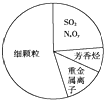
| A. | SO2和NxOy都属于酸性氧化物 | |
| B. | 雾属于胶体,能产生丁达尔效应 | |
| C. | 重金属离子可导致蛋白质变性 | |
| D. | 汽车尾气的大量排放是造成雾霾天气的人为因素之一 |
分析 A.一氧化氮、二氧化氮不属于酸性氧化物;
B.胶体的微粒直径在1-100nm之间,根据微粒直径判断;
C.重金属离子都有较多空轨道易于蛋白质形成配离子,导致蛋白质凝固变性;
D.大量燃烧化石燃料可产生有害气体和烟尘.
解答 解:A.SO2为酸性氧化物,而NxOy中的NO、NO2不属于酸性氧化物,故A错误;
B.雾中分散质粒子直径在1nm~100nm之间,具有丁达尔效应,属于胶体,故B正确;
C.重金属离子都有较多空轨道易于蛋白质形成配离子,形成配离子后蛋白质功能就丧失,使蛋白质凝固及变性,故C正确;
D.大量燃烧化石燃料可产生有害气体和烟尘,是造成雾霾天气的重要因素,故D正确;
故选A.
点评 本题考查较为综合,涉及酸性氧化物、胶体、环境污染、蛋白质性质等知识,题目难度中等,明确常见环境污染类型及治理方法为解答关键,注意掌握酸性氧化物、胶体的概念及判断方法,试题培养了学生的灵活应用能力.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 核外有38个电子,核内有95个质子 | B. | 核外有38个电子,核内有57个中子 | ||
| C. | 核外有57个电子,核内有57个质子 | D. | 核外有57个电子,核内有38个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
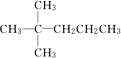 ,该烷烃分子的名称2,2-二甲基戊烷C7H16另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称3,3-二甲基-1-戊烯.
,该烷烃分子的名称2,2-二甲基戊烷C7H16另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称3,3-二甲基-1-戊烯.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
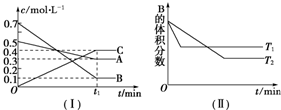
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
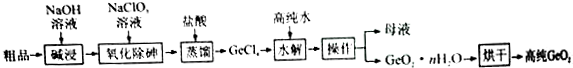
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
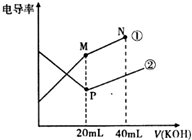
| A. | 曲线②代表0.1mol/L KOH溶液滴定CH3COOH溶液的滴定曲线 | |
| B. | 在相同温度下,P点水电离程度大于M点 | |
| C. | 在M点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L | |
| D. | 在N点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com