
| A. | 11.2L氯气中含有的原子数为NA个 | |
| B. | 标准状况下1mol苯的体积是22.4L | |
| C. | 1mol金属钠和足量的氧气反应生成过氧化钠可转移的电子数为NA | |
| D. | 1L1mol/L的硫酸钾溶液中,硫酸根和钾离子总数为2 N A |
分析 A、气体摩尔体积22.4L/mol的适用条件是标准状况;
B、气体摩尔体积22.4L/mol的使用范围是气体;
C、钠作为还原剂失去最外层上的1个电子;
D、由K2SO4=2K++SO42-电离方程式可知,1mol硫酸钾溶液中含1mol硫酸根和2mol钾离子.
解答 解:A、气体摩尔体积22.4L/mol的适用条件是标准状况,状况不知,无法求氯气的物质的量,故A错误;
B、气体摩尔体积22.4L/mol的使用范围是气体,此状况下的苯是液体,故B错误;
C、钠作为还原剂失去最外层上的1个电子,所以1 mol 金属钠作为还原剂可以提供的电子数为NA,故C正确;
D、由K2SO4=2K++SO42-电离方程式可知,1mol硫酸钾溶液中含1mol硫酸根和2mol钾离子,1L 1mol/L硫酸钾溶液中硫酸根和钾离子总数为3NA,故D错误.
故选C.
点评 本题有关阿伏伽德罗常数知识的考查,学生在解题中要注意气体摩尔体积22.4L/mol的适用条件和范围,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
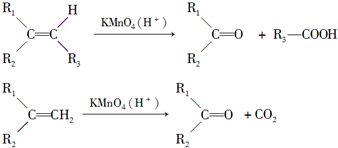
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管夹从试管底由下往上夹住试管口约$\frac{1}{3}$处,手持试管夹长柄末端,进行加热 | |
| B. | 使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中 | |
| C. | 把玻管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻管插入端,缓慢旋进塞孔中 | |
| D. | 制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | 电极材料 | 电解质溶液 | 电流指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
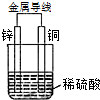 图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:| Date:2015.03.06 实验后的记录: ①Zn为阳极,Cu为阴极 ②H+向负极移动 ③电子流动方向Zn→Cu ④Zn极有H2产生 ⑤若有1mol电子流过导线,则产生H2为0.5mol. ⑥正极的电极反应式:Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
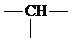 .则它的可能结构有( )
.则它的可能结构有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 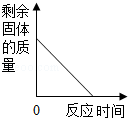 加热一定量高锰酸钾固体制取氧气 | |
| B. | 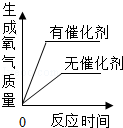 用一定量的双氧水制取氧气 | |
| C. | 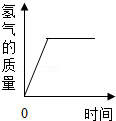 一定质量的锌粒与足量稀盐酸反应 | |
| D. | 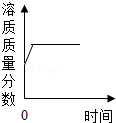 在恒温条件下往硝酸钾饱和溶液中继续加入硝酸钾固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

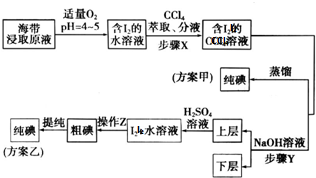
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com