
| A. | (A-x+n) mol | B. | (A-x-n) mol | C. | (A-x+n)$\frac{w}{A}$ mol | D. | (A-x-n)$\frac{w}{A}$ mol |
分析 根据阴离子核外电子数=质子数+所带电荷数计算元素R的质子数,由中子数=质量数-质子数计算Rn-含有的中子数,再根据n=$\frac{m}{M}$计算WgRn-的物质的量,结合Rn-含有的中子数,进而计算含有的中子的物质的量.
解答 解:Rn-的核外电子数为x,所以质子数为x-n,
元素R的质量数为A,所以中子数为A-(x-n)=A-x+n.
所以WgRn-所含中子的物质的量为$\frac{Wg}{Ag/mol}$×(A-x+n)=$\frac{W}{A}$(A-x+n)mol.
故选C.
点评 本题考查了中子数、质量数、质子数之间的关系以及离子核外电子数、质子数、电荷数之间的关系,注意元素的近似相对原子质量等于质量数,题目难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
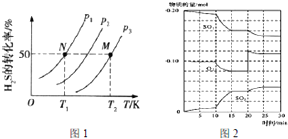
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
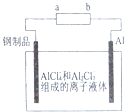 已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )
已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )| A. | a电极的电极反应式为Ag2O+H2O+2e-=2Ag+2OH- | |
| B. | 银锌电池的电解质溶液可用稀硫酸 | |
| C. | 银锌电池放电时,负极附近溶液的pH增大 | |
| D. | Al电极上发生的电极反应式为Al+7AlCl4--3e-=4Al2Cl4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一主族的元素称为碱金属 | |
| B. | 第二周期元素的最高化合价依次递增,并等于它所处的主族序数 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
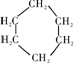 .若该有机物M能使溴水褪色,且所有碳原子共面,则M的结构简式为(CH3)2C=C(CH3)2.
.若该有机物M能使溴水褪色,且所有碳原子共面,则M的结构简式为(CH3)2C=C(CH3)2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
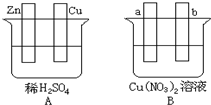 按要求对图中两极进行必要的联接并填空:
按要求对图中两极进行必要的联接并填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com