
| A. | 钙和磷都是人体内含量丰富的矿物元素,它们都属于微量元素 | |
| B. | 垃圾焚烧和发电技术的结合,既解决了污染问题,又有效利用了垃圾所含的能量 | |
| C. | 制造普通玻璃的主要反应原理之一为:CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$=CaSiO3 | |
| D. | 青霉素是最早发现的天然抗生素,其中起治疗作用的是水杨酸 |
分析 A.根据常量元素和微量元素的分类依据回答,在人体内含量超过0.01%的为常量元素;
B.垃圾会对环境有污染,垃圾焚烧和发电技术的结合,可解决污染问题,又可产生发电所需热量;
C.生产玻璃的原料是纯碱、石英和大理石;在玻璃熔炉中碳酸钙可以和二氧化硅之间发生反应生成硅酸钙和二氧化碳、碳酸钠可以和二氧化硅之间发生反应生成硅酸钠和二氧化碳;
D.青霉素是最早发现的天然抗生素,水杨酸是解热镇痛药.
解答 解:A.在人体内含量超过0.01%的为常量元素,否则为微量元素,常量元素主要有氧、碳、氢、氮、钙、磷、钾、硫、钠、氯、镁,故A错误;
B.垃圾燃烧把化学能转化内能,通过热机转化为机械能,再通过发电机转化为电能,既解决了污染问题,又有效利用了垃圾所含的能量,故B正确;
C.制造普通玻璃的主要原料是:纯碱、石灰石和石英,在玻璃熔炉中强热时的主要发生反应:SiO2+Na2CO3 $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑、SiO2+CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,故C错误;
D.青霉素属于抗生素,抗生素可以用来治疗相应的细菌性疾病,水杨酸是解热镇痛药,故D错误;
故选B.
点评 本题考查了生活中有关化学问题,熟悉人体所含微量元素、垃圾焚烧、制造普通玻璃的主要反应原理、青霉素、水杨酸等疗效是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 羧酸的官能团是羟基 | |
| B. | 羟基和氢氧根中含有的电子数不同 | |
| C. | 在氧气中燃烧只生成二氧化碳和水的有机物一定是烃 | |
| D. | 乙醇与钠反应生成氢气,此现象说明乙醇具有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在密闭容器中发生反应:X+2Y?2Z(△H<0),其中Z显气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图,下列判断正确的是( )
在密闭容器中发生反应:X+2Y?2Z(△H<0),其中Z显气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图,下列判断正确的是( )| A. | Y一定呈气态 | |
| B. | T1大于T2 | |
| C. | 升高温度,该反应的化学平衡常数增大 | |
| D. | 当c(X):c(Y):c(Z)=1:2:2时,反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 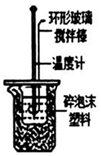 用图所示装置测定中和反应的反应热 | |
| B. |  用图所示装置在实验室制取少置乙烯 | |
| C. | 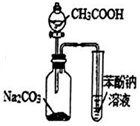 用图3所示装置证明碳酸酸性强于苯酚 | |
| D. | 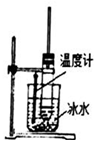 用图所示装置在实验室制取少量硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
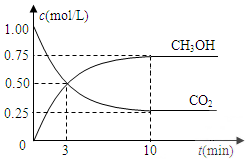 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积固定为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积固定为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 地壳中含量最高的非金属元素 |
| Y | M层比K层多1个电子 |
| Z | 最外层电子数为内层电子数的0.6倍 |
| W | 与氯形成的氯化物是生活中常用的调味品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com