

分析 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,则X为H元素;Y、Z左右相邻,Z、W位于同主族,原子序数Y<Z<W,则三者的相对位置为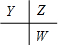 ,设Y的原子序数为a,则Z的原子序数为a+1,W的原子序数为a+9,所以a+a+1+a+9=32-1,解得:a=7,故Y为N元素,Z为O元素,W为S元素,据此结合元素周期律知识进行解答.
,设Y的原子序数为a,则Z的原子序数为a+1,W的原子序数为a+9,所以a+a+1+a+9=32-1,解得:a=7,故Y为N元素,Z为O元素,W为S元素,据此结合元素周期律知识进行解答.
解答 解:原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,则X为H元素;Y、Z左右相邻,Z、W位于同主族,原子序数Y<Z<W,则三者的相对位置为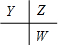 ,设Y的原子序数为a,则Z的原子序数为a+1,W的原子序数为a+9,所以a+a+1+a+9=32-1,解得:a=7,故Y为N元素,Z为O元素,W为S元素,
,设Y的原子序数为a,则Z的原子序数为a+1,W的原子序数为a+9,所以a+a+1+a+9=32-1,解得:a=7,故Y为N元素,Z为O元素,W为S元素,
(1)X和W组成的化合物为硫化氢,H2S为共价化合物,分子中存在两个H-S键,用电子式表示其形成过程为: ,
,
故答案为:
(2)由X与Z组成的化合物,常用于杀菌消毒,该化合物为双氧水,双氧水的结构式为:H-O-O-H,
故答案为:H-O-O-H;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液不能与铜反应、浓溶液能与铜反应,该强酸为硫酸,铜与浓硫酸反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(4)①由氢、氮、氧、硫组成的离子化合物可能为硫酸铵、硫酸氢铵、亚硫酸铵、亚硫酸氢铵等,1 mol生成气体2 mol说明一分子这种离子化合物中含有2分子铵根离子,铵根离子与氢氧根离子反应方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑;
②此种化合物与氯气反应说明为亚硫酸根离子,故此种化合物为亚硫酸铵,与氯气反应的离子方程式为②SO32-+Cl2+H2O=SO42-+2Cl-+2H+,
故答案为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+;
(5)B中含有氢、氮、氧、硫、铁五种元素,取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色,说明B中有亚铁离子和铵根离子,B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,说明有硫酸根离子,1mol B中含有6mol结晶水,说明B带六个结晶水,由相对分子质量为392可知分子式只能为(NH4)2Fe (SO4)2•6H2O,
故答案为:(NH4)2Fe (SO4)2•6H2O.
点评 本题考查了位置、结构与性质的关系,题目难度中等,利用原子序数关系来判断元素的种类为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题侧重考查学生的分析、理解能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
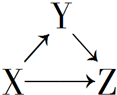 X、Y、Z有如图所示的转化关系,则X和Y可能是( )
X、Y、Z有如图所示的转化关系,则X和Y可能是( )| A. | ①②③④ | B. | ①② | C. | ③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去瓷器表面污垢可以选用热的烧碱溶液 | |
| B. | 溶质质量分数:医用酒精>食醋>生理盐水 | |
| C. | 绚丽缤纷的烟花是因添加了钾、钠、钙、铜等金属元素的焰色反应形成的 | |
| D. | 研制开发燃料电池汽车,降低机动车尾气污染,某种程度上可以减少PM2.5污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数为2的元素一定处于周期表IIA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5 | |
| C. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| D. | 同主族元素形成的氧化物的晶体类型均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 每有0.1molO2反应,则迁移H+0.4mol | |
| B. | 该电池为可充电电池 | |
| C. | 电子移动方向:电极a→磷酸溶液→电极b | |
| D. | 正极反应式为:CH2=CH2-2e-+2OH→CH3CHO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、NO3-、Cl-、 | B. | H+、Fe2+、ClO-、SO42- | ||
| C. | K+、Fe3+、C6H5O-、SCN- | D. | NH4+、Al3+、SiO32-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
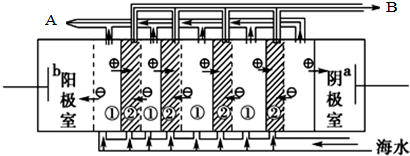 电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.
电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.| CaSO4 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com