
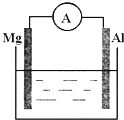
 (1)如图所示,烧杯中的溶液为稀硫酸,则观察到的现象为
(1)如图所示,烧杯中的溶液为稀硫酸,则观察到的现象为 ,负极(Cu):Cu-2e-=Cu2+,正极(C):2Fe3++2e-=2Fe2+;
,负极(Cu):Cu-2e-=Cu2+,正极(C):2Fe3++2e-=2Fe2+; ,
, ,观察构成的原电池装置,有气泡生成的一极的金属活泼性弱,另一极活泼性强.
,观察构成的原电池装置,有气泡生成的一极的金属活泼性弱,另一极活泼性强.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、汽车尾气中的NOx是造成光化学烟雾的唯一因素 |
| B、空气中SO2、NOx等是形成酸雨的重要原因 |
| C、冬天撒盐熔雪能造成土壤和水污染 |
| D、河流人海口处形成的三角洲是海水使河水泥沙胶体凝聚的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9.02 g |
| B、8.51 g |
| C、8.26 g |
| D、7.04 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 80℃,通电 |
| Ⅰ |
| 室温,KCl |
| Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解质溶液可能为HNO3 |
| B、正极材料可能为Zn |
| C、正极材料可能为Cu |
| D、负极上:Fe失电子被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com