
分析 (1)根据c=$\frac{1000ρw}{M}$计算出密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度;假设密度相同,混合后质量分数为40%,由于硫酸的质量分数越大,溶液中含有的硫酸的质量越大,所以混合后硫酸的质量分数大于40%;
(2)20%发烟硫酸可表示为SO3•nH2O,通过整理即为:nH2SO4•(1-n)SO3,根据20%发烟硫酸中H2SO4和SO3的质量关系可得:98n:80(1-n)=(1-20%):20%,解出n即可;
(3)①采用极限法计算与固体混合物反应需要的硝酸的物质的量,剩余的硝酸与(NH4)2Fe(SO4)2溶液反应计算需要的(NH4)2Fe(SO4)2溶液的体积;
②先根据(NH4)2Fe(SO4)2的物质的量计算与其反应的硝酸的物质的量,设固体混合物中两固体的质量,根据两固体的质量计算需要的硝酸的物质的量,然后列式计算出两固体的质量,根据质量分数公式计算即可.
解答 解:(1)密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度为:$\frac{1000×1.4×50%}{98}$mol/L≈7.14mol/L;假如50%的硫酸与30%的硫酸密度相同,则混合后硫酸的质量分数为40%,由于50%的硫酸的密度大于30%的硫酸,所以混合后溶液中硫酸的质量偏大,硫酸的质量分数大于40%,
故答案为:7.14;>;
(2)20%发烟硫酸可表示为SO3•nH2O,通过整理即为:nH2SO4•(1-n)SO3,根据20%发烟硫酸中H2SO4和SO3的质量关系可得:98n:80(1-n)=(1-20%):20%,解得n=0.77,
故答案为:0.77;
(3)①硝酸的物质的量为:0.20L×2mol/L=0.4mol,
假设固体混合物全部为Cu2S,则n(Cu2S)=$\frac{8.64g}{160g/mol}$=0.054mol,需要是硝酸的物质的量为x,
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
3 16
0.054mol x
x=$\frac{0.054mol×16}{3}$=0.288mol,
剩余的硝酸的物质的量为:0.4mol-0.288mol=0.112mol,
0.112mol硝酸和(NH4)2Fe(SO4)2溶液完全反应.
NO3-+3Fe2++4H+→NO↑+3Fe3++2H2O
3mol 4
1×10-3VL×2mol/L 0.112mol
解得V=42,
假设固体混合物全部为CuS,则n(CuS)=$\frac{8.64g}{96g/mol}$=0.09mol,需要硝酸的物质的量为y,
8NO3-+3CuS+8H+→3Cu2++3SO42-+8NO↑+4H2O,
3 8
0.09mol y
y=$\frac{0.09mol×8}{3}$=0.24mol
剩余的硝酸的物质的量为:0.4mol-0.24mol=0.16mol.
0.112mol硝酸和(NH4)2Fe(SO4)2溶液完全反应.
NO3-+3Fe2++4H+→NO↑+3Fe3++2H2O
3mol 4
1×10-3VL×2mol/L 0.16mol
解得V=60,
所以V值范围为:42<V<60,
故答案为:42~60mL;
②若V=48,与48mL(NH4)2Fe(SO4)2溶液完全反应需要硝酸的物质的量为:
NO3-+3Fe2++4H+→NO↑+3Fe3++2H2O
3mol 4
0.048L×2mol/L n
解得:n=0.128mol,
所以消耗的硝酸的物质的量为0.128mol,
故与固体混合物反应的硝酸的物质的量为:0.4mol-0.128mol=0.272mol,
设Cu2S的物质的量xmol,CuS的物质的量为ymol,160x+96y=8.64g①.
10NO3-+3Cu2S+16H+=6Cu2++10NO↑+3SO42-+8H2O
3 16
x $\frac{16x}{3}$
8NO3-+3CuS+8H+→3Cu2++3SO42-+8NO↑+4H2O,
3 8
y $\frac{8y}{3}$
$\frac{16}{3}$x+$\frac{8}{3}$y=0.272②
由①②解得:$\left\{\begin{array}{l}{x=0.036}\\{y=0.03}\end{array}\right.$,
合物中CuS的质量分数为:$\frac{96g/mol×0.03mol}{8.64g}$≈0.33,
故答案为:0.33.
点评 本题考查了物质的量浓度的计算、化学方程式的计算等知识,为高频考点,侧重于学生的分析、计算能力的考查,题目难度较大,涉及的计算量稍大,注意掌握物质的量概念及表达式,明确根据化学方程式进行计算的方法,其中(3)为难点,涉及到极端讨论法解题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

 .
. .
. .
.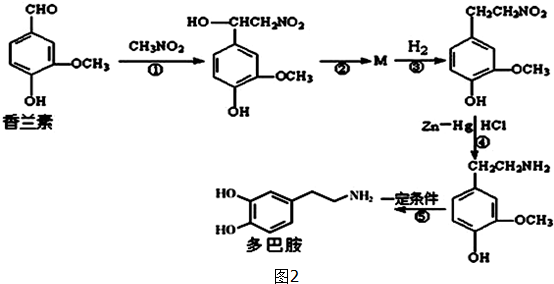
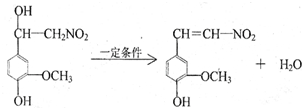 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 B.(CH3)3CCH2CH3 C.
B.(CH3)3CCH2CH3 C. D.正己烷.
D.正己烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定.当滴定到消耗20mlHCl时所得溶液中离子浓度间的关系有:5c(Cl-)═4c(HCO3-)+4c(CO32-)+4c(H2CO3) | |
| B. | 常温下物质的量浓度相等的①(NH4)2CO3 ②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液中水的电离程度:③>①>② | |
| C. | 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:C(CH3COO-)>C(CH3COOH)>C(H+)>C(OH-) | |
| D. | 等体积等物质的量浓度的NaF溶液与NaCl溶液中离子总数:N(NaF)>N(NaCl) |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:选择题
贝诺酯是由阿司匹林、扑热息痛经化学法拼合制备的解热镇痛抗炎药,其合成反应式(反应条件略去)如下,
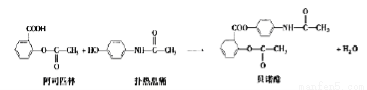
下列叙述错误的是
A.FeCl3溶液可区别阿司匹林和扑热息痛
B.1mol阿司匹林最多可消耗3molNaOH
C.常温下贝诺酯在水中的溶解度大干扑热息痛的
D.扑热息痛发生类似酯水解反应的产物之一分子式为C6H7NO2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤和石油都是混合物,均由碳和氢两种元素组成 | |
| B. | 液化石油气和天然气的主要成分都是甲烷 | |
| C. | 煤的干馏和石油的分馏发生的都是化学变化 | |
| D. | 用溴的四氯化碳溶液可鉴别分馏获得的汽油和裂化获得的汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
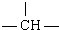 一个-OH,其余为甲基,则甲基个数为( )
一个-OH,其余为甲基,则甲基个数为( )| A. | 2n+3m-1 | B. | m+n-1 | C. | n+2m+1 | D. | n+1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com