
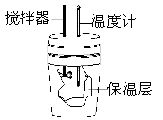
用100mL1.0mol?L-1HCl与100mL1.0mol?L-1NaOH溶液在如图所示的简易量热计中进行中和反应,以测定其反应热。回答下列问题:
(1)搅拌器的作用是__________________。
(2)如果没有保温层,则测定结果将_________(填“偏高”、“偏低”或“无影响”)。
(3)实验时所用HCl及NaOH溶液的密度均为1g?cm-3,生成溶液的比热容为4.18kJ?K-1?kg-1,实验起始温度为t1K ,终止温度为t2K 。则反应热Q=______________。
科目:高中化学 来源: 题型:

 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=查看答案和解析>>
科目:高中化学 来源:2013届江苏省南京学大教育专修学校高三4月月考化学试卷(带解析) 题型:填空题
某铜矿石含氧化铜、氧化亚铜、三氧化二铁和大量脉石(SiO2),现采用酸浸法从矿石中提取铜,其流程图如下:
已知: ①当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;②反萃取后的水层是硫酸铜溶液,Cu2+浓度约为50g/L。回答下列问题:
(1)矿石用稀硫酸浸出过程中氧化亚铜发生的反应为:Cu2O+2H+===Cu2++Cu+H2O;请写出该过程中发生的另一个氧化还原反应的离子方程式: 。
(2)写出用惰性电极电解水层的电解总反应方程式: 。
(3)循环中反萃取剂B的主要成分是 。
(4)某铜矿石样品中,若仅含氧化亚铜、三氧化二铁和脉石三种物质。取该矿石样品200.0g,用100mL1.0mol?L—1H2SO4溶液浸取后,还需加入10mL 1.0mol?L—1 Fe2(SO4)3溶液才能使铜全部浸出,浸取液经充分电解后可得到 6.4gCu。求铜矿石样品中氧化亚铜和氧化铁的质量分数?
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省高三4月月考化学试卷(解析版) 题型:填空题
某铜矿石含氧化铜、氧化亚铜、三氧化二铁和大量脉石(SiO2),现采用酸浸法从矿石中提取铜,其流程图如下:

已知: ①当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;②反萃取后的水层是硫酸铜溶液,Cu2+浓度约为50g/L。回答下列问题:
(1)矿石用稀硫酸浸出过程中氧化亚铜发生的反应为:Cu2O+2H+===Cu2++Cu+H2O;请写出该过程中发生的另一个氧化还原反应的离子方程式: 。
(2)写出用惰性电极电解水层的电解总反应方程式: 。
(3)循环中反萃取剂B的主要成分是 。
(4)某铜矿石样品中,若仅含氧化亚铜、三氧化二铁和脉石三种物质。取该矿石样品200.0g,用100mL1.0mol?L—1H2SO4溶液浸取后,还需加入10mL 1.0mol?L—1 Fe2(SO4)3溶液才能使铜全部浸出,浸取液经充分电解后可得到 6.4gCu。求铜矿石样品中氧化亚铜和氧化铁的质量分数?
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com