
| A. |  | B. | C2H2 | C. |  | D. | 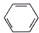 |
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和CH3CH2CH3 | B. | ${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl | ||
| C. | 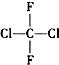 和 和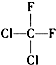 | D. |  和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应涉及到离子键和共价键的断裂与形成 | |
| B. | 该反应中,化学能只转变为热能 | |
| C. | 断开1molH-H键和1molCl-Cl键所吸收的总能量,小于形成1molH-Cl键所放出的能量 | |
| D. | 反应物所具有的总能量高于产物所具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、次氯酸钠溶液的消毒原理相同 | |
| B. | 双氧水和次氯酸钠具有较强的腐蚀性,不能用于皮肤的消毒 | |
| C. | 高锰酸钾溶液和双氧水均可以将病毒氧化而达到消毒的目的 | |
| D. | 在次氯酸钠溶液中通入少量二氧化硫可发生反应:2NaClO+SO2+H2O═Na2SO3+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
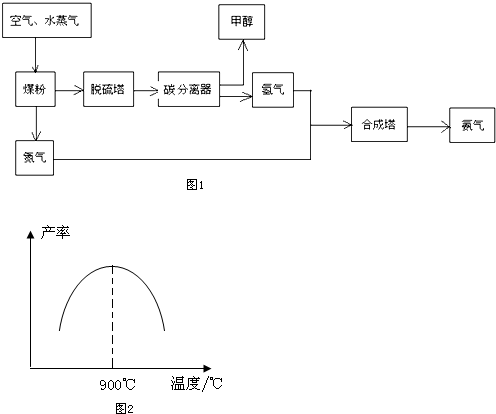
| 物质 | H2 | CO | C H3OH |
| 浓度/(mol•L-1) | 0.20 | o.10 | o.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
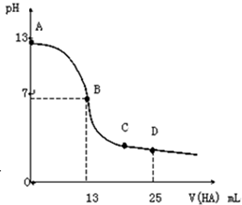 常温下,向25mL0.1mol•L-1MOH溶液中逐滴加入0.2mol•L-1HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL0.1mol•L-1MOH溶液中逐滴加入0.2mol•L-1HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com