
【题目】对下列实验过程的评价,正确的是( )
A. 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B. 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO![]()
C. 用萃取的方法分离汽油和煤油
D. 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl-
科目:高中化学 来源: 题型:
【题目】阿司匹林是一种解毒镇痛药。烃A是一种有机化工原料,下图是以它为初始原料设计合成阿司匹林关系图:
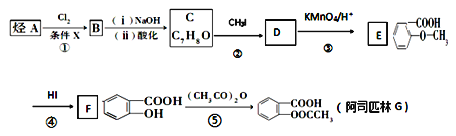
已知:①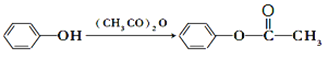
②烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:![]()
③![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)C的结构简式为_______________。
(2)反应④的反应类型________,在③之前设计②这一步的目的是_____________。
(3)G(阿司匹林)与足量NaOH溶液反应的化学方程式为_____________________。
(4)符合下列条件的E的同分异构体有________种。写出核磁共振氢谱中有四组峰,峰面积之比为3:2:2:1的结构简式:________________(只写一种)。
a.苯环上有两个取代基
b.遇氯化铁溶液显紫色
c.能发生水解反应
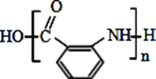
(5)利用甲苯为原料,结合以上合成路线和信息合成功能高分子材料(如图,无机试剂任选)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5.1镁铝混合物放入足量氢氧化钠溶液中充分反应后,生成气体在标准状况的体积为2.24L。
计算:(请写详细的计算步骤)
(1)混合物中含有镁的质量为多少克____________?
(2)若反应完成后,溶液体积为50mL,则溶液中含铝化合物的物质的量浓度为多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. [Ne]3s2表示的是Mg原子
B. 3p2表示第三能层有2个电子
C. 同一原子中,1s、2s、3s电子的能量逐渐减小
D. 2p、3p、4p能级容纳的最多电子数依次增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】夹紧下列装置中的弹簧夹并进行相关操作。下列情形中,表明相应装置漏气的是( )
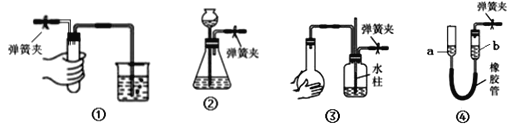
A. 装置①中,用手捂住试管,烧杯中出现气泡,放开手后,导管中形成一段稳定的水柱
B. 装置②中,向长颈漏斗中加入一定量水,形成水柱,随后水柱下降至与瓶中液面相平的位置
C. 装置③中,双手捂住烧瓶,导管中形成一段稳定的水柱,双手放开后,水柱慢慢回落
D. 装置④中,将a管向上提至一段高度,a、b两管之间水面形成稳定的高度差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色能源是指使用过程中不排放或排放极少污染物的能源,如一级能源中的水能、地热能、天然气等;二级能源中的电能、氢能等.下列能源属于绿色能源的是( ) ①太阳能 ②风能 ③石油 ④煤 ⑤潮汐能.
A.①②③
B.③④⑤
C.②④⑤
D.①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
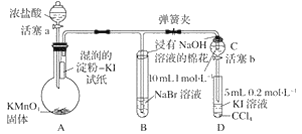
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是_________________________________________。
(2)B中溶液发生反应的离子方程式是____________________________________________。
(3)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是________________________________。
(4)过程Ⅲ实验的目的是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列原子半径最小的是( )
A. 1s22s22p3 B. 1s22s22p33s23p3
C. 1s22s22p5 D. 1s22s22p33s23p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS) 是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣 (有效成分为Fe2O3和Fe3O4) 制备PFS,其工艺流程如下图所示。
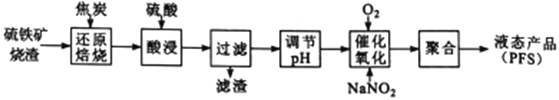
(1)“还原焙烧”过程中,CO还原Fe3O4生成FeO的热化学方程式为___________________________。
已知:Fe3O4(s)+C(s)=3FeO(s)+CO(g) ΔH1= 191.9kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
C(s)+CO2(g) =2CO(g) ΔH3= 172.5kJ·mol-1
(2)CO是“还原焙烧" 过程的主要还原剂。下图中,曲线表示4个化学反应a、b、c、d达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域。a属于_________(填“吸热反应”或“放热反应”);570℃时,d反应的平衡常数K=_________________。
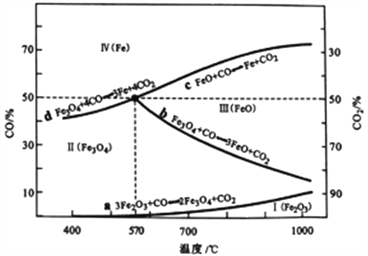
(3)工业上,“还原培烧”的温度一般控制在800℃左右,温度不宜过高的理由是____________________。
(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是___________________________。
(5)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17, Ksp[Fe(OH)3]=1.0×10-39,若浸出液中c(Fe2+) =10-1.8mol·L-1,为避免“催化氧化”过程中产生Fe(OH)3,应调节浸出液的pH≤_____________。
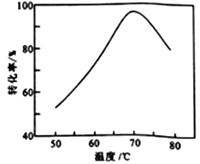
(6)FeSO4溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,该反应的离子方程式为_________________________。“催化氧化”过程用NaNO2作催化剂(NO起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+转化率随温度的升高先上升后下降的原因是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com