
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:
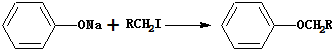
| 一定条件 |


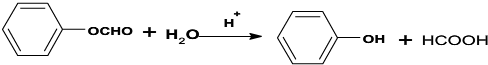

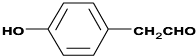

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.蛋白质属于天然高分子化合物,组成元素只有C、H、O、N | B、.用浓Na2SO4、CuSO4溶液或浓HNO3溶液使蛋清液发生盐析,进而分离、提纯蛋白质 | C、.蛋白酶是蛋白质,它不仅可以催化蛋白质的水解反应,还可以催化淀粉的水解反应 | D、.蛋白质水解产生的甘氨酸(H2N-CH2-COOH)既显酸性,又显碱性,是最简单的氨基酸 |
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(新课标Ⅰ卷带解析) 题型:填空题
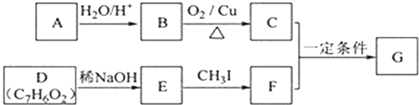
[化学—选修5:有机化学基础](15分)
査尔酮类化合物G是黄酮类药物的主要合成中间体,其中一种合成路线如下: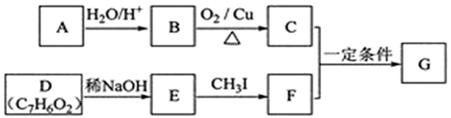
已知以下信息:
① 芳香烃A的相对分子质量在100 ~110之间,1mol A充分燃烧可生成72g水。
② C不能发生银镜反应。
③ D能发生银镜反应、可溶于饱和Na2CO3溶液、核磁共振氢谱显示有4种氢。
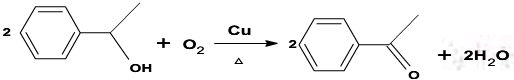
④ 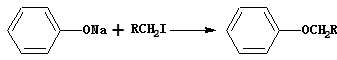
⑤ RCOCH3 + RˊCHO RCOCH = CHRˊ
RCOCH = CHRˊ
回答下列问题:
(1)A的化学名称为 。
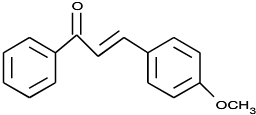
(2)由B生成C的化学方程式为 。
(3)E的分子式为 ,由E生成F的反应类型为 。
(4)G的结构简式为 。
(5)D的芳香同分异构体H既能发生银镜反应,又能发生水解反应,H在酸催化下发生水解反应的化学方程式为 。
(6)F的同分异构体中,既能发生银镜反应,又能与FeCl3溶液发生显色反应的共有 种,其中核磁共振氢谱为5组峰,且峰面积比为2∶2∶2∶1∶1的为 (写结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com