
| O2 |
| O2 |
| H2O |
 ,故答案为:
,故答案为: ;
;
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 编号 | 操作 | 现象 | 结论 |
| A | 将样品与氢氧化钠浓溶液混合共热后产生的气体用湿润的蓝色石蕊试纸检验 | 试纸没有变红 | 该样品中不含NH4+ |
| B | 往无色溶液中滴加氯化钡溶液,再加稀盐酸 | 产生白色沉淀 该沉淀不溶解 | 该溶液中含有SO42- |
| C | 将某无色气体通入澄清的石灰水中 | 石灰水变浑浊 | 该气体为CO2 |
| D | 某气体呈黄绿色,用湿润的淀粉碘化钾试纸检验 | 试纸变蓝 | 该气体为Cl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | 原子结构或元素性质 |
| X | 最高正价=|最低负价| |
| Y | 原子核及核外各层电子的排布情况如图: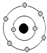 |
| Z | 原子结构示意图: |
| L | 原子半径为同周期主族元素中最大 |
| M | 其原子序数比L大2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ④氕、氘、氚
④氕、氘、氚查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空:
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、参加反应的金属质量相等 |
| B、消耗两种金属的物质的量相同 |
| C、反应中电子转移的电子总数相等 |
| D、消耗铁、铝的质量比为56:18 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com