


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
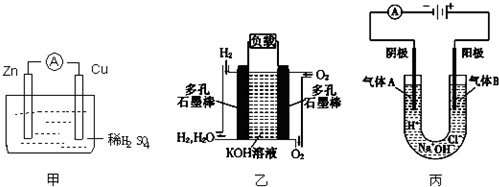
 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用如图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用如图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、SiO2、CO均为酸性氧化物 |
| B、稀豆浆、硅酸、氯化铁溶液均为胶体 |
| C、烧碱、冰醋酸、四氯化碳均为电解质 |
| D、漂白粉、水玻璃、氨水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20mL | B、100mL |
| C、200mL | D、300mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用两根铜棒电解稀盐酸:2H++2Cl-
| ||||
| B、碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-=CaCO3↓+2OH- | ||||
| C、用FeS除去工业废水中的Hg2+:Hg2++S2-═HgS↓ | ||||
| D、等物质的量的Ba(OH)2与KAl(SO4)2?12H2O溶液混合:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2、I2、HI的分子数之比为1:1:2 |
| B、混合气体的颜色不再发生变化 |
| C、单位时间生成n mol H2,同时消耗2n mol HI |
| D、混合气体的密度保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com