
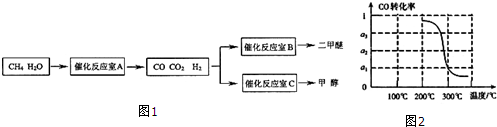
分析 (1)催化反应室B中CO与H2合成二甲醚,由元素守恒可知有水生成;
(2)①由原子利用率定义可知,反应(Ⅳ)的原子利用率=$\frac{Mr(C{H}_{3}OH)}{Mr(C{H}_{3}OH)+Mr({H}_{2}O)}$×100%;
②反应(Ⅳ)是气体物质的量减小的反应,混乱度减小;
③由图开始,随温度升高,CO的转化率减小,说明升高温度平衡逆向移动,正反应为放热反应;
300℃平衡时CO转化率为α1,则:
CO(g)+2 H2(g)?CH3OH(g)
起始量(mol):a 2a 0
变化量(mol):aα1 2aα1 aα1
平衡量(mol):a(1-α1) 2a(1-α1) aα1
再根据平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算;
(3)废气中二氧化硫为VxL,由整个过程、结合电子转移守恒可得关系式CH3OCH3~12SO2,据此计算.
解答 解:(1)催化反应室B中CO与H2合成二甲醚,由元素守恒可知有水生成,反应方程式为:2CO+4H2$?_{△}^{催化剂}$CH3OCH3+H2O,故答案为:2CO+4H2$?_{△}^{催化剂}$CH3OCH3+H2O;
(2)①由原子利用率定义可知,反应(Ⅳ)的原子利用率=$\frac{Mr(C{H}_{3}OH)}{Mr(C{H}_{3}OH)+Mr({H}_{2}O)}$×100%=$\frac{32}{32+18}$×100%=64%,故答案为:64%;
②反应(Ⅳ)是气体物质的量减小的反应,混乱度减小,故△S<0,故答案为:<;
③由图开始,随温度升高,CO的转化率减小,说明升高温度平衡逆向移动,正反应为放热反应,则△H<0;
300℃平衡时CO转化率为α1,则:
CO(g)+2 H2(g)?CH3OH(g)
起始量(mol):a 2a 0
变化量(mol):aα1 2aα1 aα1
平衡量(mol):a(1-α1) 2a(1-α1) aα1
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{a{α}_{1}}{V}}{\frac{a(1-{α}_{1})}{V}×[\frac{2a(1-{α}_{1})}{V}]^{2}}$=$\frac{{α}_{1}{V}^{2}}{4{a}^{2}(1-{α}_{1})^{3}}$,
故答案为:$\frac{{α}_{1}{V}^{2}}{4{a}^{2}(1-{α}_{1})^{3}}$;
(3)废气中二氧化硫为VxL,由整个过程、结合电子转移守恒可得关系式CH3OCH3~12SO2,设消耗二甲醚的质量为m,则:
CH3OCH3~12SO2
46g 12×22.4L
m Vx L
所以m=$\frac{46g×VxL}{12×22.4L}$=$\frac{23Vx}{133.4}$g,
故答案为:$\frac{23Vx}{133.4}$g.
点评 本题考查化学平衡计算与影响因素、电化学等,(3)中计算涉及过程繁琐,注意利用关系式解答,难度中等.


科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)=c(R+)=0.01mol•L-1 | B. | c(R+)>c(H+) | ||
| C. | c(ROH)<c(R+) | D. | c(ROH)<c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的化学方程式为:X+Y?2Z | |
| B. | 当反应速率大小关系为:v(X)=v(Y)=2v(Z)时,该反应达到平衡状态 | |
| C. | 图a中反应达到平衡时,Y的转化率为37.5% | |
| D. | 该反应的正反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示.分析有关数据,写出X、Y、Z反应的化学方程式X+3Y
(1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示.分析有关数据,写出X、Y、Z反应的化学方程式X+3Y 2Z.
2Z.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com