

| 261 |
| x |
| 233 |
| mg |
| 261m |
| 233 |
| 261m | ||
|
| 261m |
| 233w |
| 261m |
| 233w |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CH2�TCH-CH�TCH2 |
| B��CH2�TCH-CH2-CH3 |
C�� |
| D��CH��C-CH2-CH3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
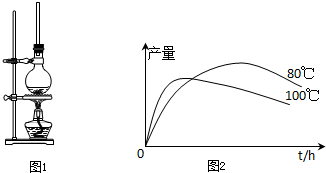 1-����������һ����ɫҺ�壬�ܶȱ�ˮ������ˮ���������Ҵ����۵�5.5�棬�е�267�森1-���ӣ������뱽�����ƣ��۵�96�棬�е�278�棬����ˮ���������Ҵ����Ҵ��ķе�Ϊ��5�森1-�����������������ϣ�Ҳ�ɺϳ��������ϣ�ʵ�����Ʊ�1-���������Ĺ������£�
1-����������һ����ɫҺ�壬�ܶȱ�ˮ������ˮ���������Ҵ����۵�5.5�棬�е�267�森1-���ӣ������뱽�����ƣ��۵�96�棬�е�278�棬����ˮ���������Ҵ����Ҵ��ķе�Ϊ��5�森1-�����������������ϣ�Ҳ�ɺϳ��������ϣ�ʵ�����Ʊ�1-���������Ĺ������£�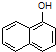 +C2H5OH
+C2H5OH| H2SO4 |
| �� |
 +H2O
+H2O| ʵ��Ŀ�� | ʵ����� | Ԥ������ͽ��� |
| ���ý����Ƽ���1-���������Ƿ� | ȡ�������ᴿ�IJ�Ʒ���Թ�A�У���������� | �� �� |
| �ڼ��龭�ᴿ�IJ�Ʒ�Ƿ���1-���� | �� �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ���� | ��ʼ���� | ������ȫ |
| Fe��OH��3 | 2.7 | 3.7 |
| Fe��OH��2 | 7.6 | 9.6 |
| Mn��OH��2 | 8.3 | 9.8 |
| Mg��OH��2 | 9.6 | 11.1 |
| �Լ� | �۸�Ԫ/�֣� |
| ƯҺ����NaClO��25.2%�� | 450 |
| ˫��ˮ����H2O2��30%�� | 2400 |
| �ռ��98% NaOH�� | 2100 |
| �����99.5% Na2CO3�� | 600 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
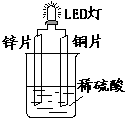 ��ͼ�ǿ���С����Ƶ��û�ѧ��ԴʹLED�Ʒ����װ�ã�����˵��������ǣ�������
��ͼ�ǿ���С����Ƶ��û�ѧ��ԴʹLED�Ʒ����װ�ã�����˵��������ǣ�������| A��ͭƬ�������������� |
| B��װ���д��ڡ���ѧ�ܡ����ܡ����ܡ���ת�� |
| C����������ỻ������֭�������в����е������� |
| D�������пƬ������Ƭ����·�еĵ������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com