
| A. | 分液时,分液漏斗中下层液体从下端流出,上层液体从漏斗上口倒出 | |
| B. | 萃取操作是针对互溶的液体物质间物质沸点的不同所进行的分离 | |
| C. | 容量瓶用蒸馏水洗涤后须烘干后才能使用 | |
| D. | 为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 |
分析 A.为防止液体污染,分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出;
B.蒸馏是利用各种物质的沸点不同将混合物分离或提纯;
C.定容时还需要向容量瓶中加入蒸馏水;
D.浓溶液稀释或固体溶解产生大量的热量,易损坏容量瓶.
解答 解:A.为防止液体污染,分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,故A正确;
B.萃取是利用溶质在不同溶剂中溶解度的不同,故B错误;
C.定容时还需要向容量瓶中加入蒸馏水,不需要烘干,故C错误;
D.容量瓶为精密仪器,浓溶液稀释或固体溶解产生大量的热量,容易损坏容量瓶,故D错误.
故选A.
点评 本题考查常见实验的基本操作,熟悉实验的原理、了解实验仪器的使用方法是解题的关键,难度不大,注意加强实验知识的积累.


科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硫酸 | Na2S | AgNO3与 AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| B | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性:MnO2>Cl2>Br2 | |
| C | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
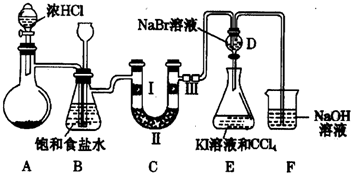
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若金属全部溶解,则溶液中一定含有Fe3+ | |
| B. | 若金属有剩余,向溶液中再滴入硫酸后,金属不会发生溶解 | |
| C. | 当溶液中金属离子只含有Fe3+、Cu2+时,则c与a、b的关系为:c=80a$\frac{1-b}{3}$ | |
| D. | 若金属全部溶解,且产生336mL气体(标准状况),则c=0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学家可以制造出自然界中不存在的物质 | |
| B. | 化学的特征就是认识分子和制造分子,是一门具有创造性和实用性的科学 | |
| C. | 利用化学变化可以制造出新的分子,但不能制造出新的原子 | |
| D. | 化学研究会造成严重的环境污染,最终人类将会毁灭在化学物质中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作可在普通漏斗中完成 | |
| B. | 浓烧碱液沾到皮肤上应立即用稀盐酸冲洗 | |
| C. | 用酒精灯加热试管内液体时一定要先给试管预热再集中加热液体部位 | |
| D. | 用托盘天平称出25.20g氯化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com