
分析 I (1)①磷酸为三元中强酸,但一般处理为弱酸,以第一步电离为主;
②根据化合价代数和为0;
(2)H2PO2-+Ag++=PO43-+Ag+,P元素由+1价升高到+5价,升高了4价,Ag元素由+1价降到0价,降低了1价,根据化合物价升降守恒、电荷守恒、原子守恒配平;
(3)①加入足量的氧气和水,是为了保证氮氧化物最大可能的转变为硝酸,提高氮氧化物的转化率,减少氮氧化物对环境的污染;
②由于Cu2+发生水解,蒸发浓缩时,防止水解生成氢氧化铜沉淀;
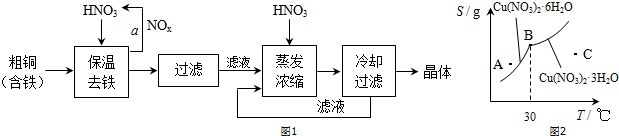
③a.图中曲线所有的点均为对应温度下的饱和溶液,上方的点为过饱和溶液;
b.B点表明在30℃时两种晶体的溶解度相等,B点为生成晶体的转折点,两种晶体可以共存;
c.上述流程是在低温下进行的,最终得到的晶体是Cu(NO3)2•6H2O;
d.由图象可以看出,溶液降温至30℃以下,可以析出Cu(NO3)2•6H2O晶体;
Ⅱ(4)Ag+(aq)+2NH3(aq)=Ag(NH3)2+(aq),该反应平衡常数的表达式=$\frac{c(Ag(N{H}_{3}{)_{2}}^{+})}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$,可逆反应AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数 K=$\frac{c(C{l}^{-})c(Ag(N{H}_{3}{)_{2}}^{+})}{{c}^{2}(N{H}_{3})}$=$\frac{c(C{l}^{-})c(Ag(N{H}_{3}{)_{2}}^{+})}{{c}^{2}(N{H}_{3})}$×$\frac{c(A{g}^{+})}{c(A{g}^{+})}$=Ksp(AgCl)×K稳;1L 1mol/L氨水中最多可以溶解AgCl可以依据化学平衡常数计算.
解答 解:I (1)①磷酸为三元中强酸,但一般处理为弱酸,以第一步电离为主,电离方程式为H3PO4?H2PO4-+H+,故答案为:H3PO4?H2PO4-+H+;
②根据化合价代数和为0,(NH4)(n+2)PnOx,中,(n+2)×1+5n-2x=0,x=3n+1,故答案为:3n+1;
(2)H2PO2-+Ag++=PO43-+Ag+,P元素由+1价升高到+5价,升高了4价,Ag元素由+1价降到0价,降低了1价,根据化合物价升降守恒可配得H2PO2-+4Ag++=PO43-+4Ag+,根据电荷守恒,反应物缺少6mol负电荷,故补充6OH-,根据质量守恒,生成物缺少4H2O,反应方程式为H2PO2-+4Ag++6OH-=PO43-+4Ag+4H2O,故答案为:1;4;6OH-;1;4;4H2O;
(3)①加入足量的氧气和水,是为了保证氮氧化物最大可能的转变为硝酸,提高氮氧化物的转化率,减少氮氧化物对环境的污染,故答案为:有利于提高原料的利用率,减少污染物的排放;
②由于Cu2+发生水解,蒸发浓缩时,要用硝酸调节溶液的pH=1,防止水解生成氢氧化铜沉淀,Cu2++2H2O?Cu(OH)2+2H+,加入硝酸可抑制水解,
故答案为:由于Cu2+发生水解反应Cu2++2H2O?Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解;
③a.在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度溶解度,可知图中曲线所有的点均为对应温度下的饱和溶液,上方的点为过饱和溶液,故a错误;
b.B点表明在30℃时两种晶体的溶解度相等,B点为生成晶体的转折点,两种晶体可以共存,故b正确;
c.上述流程是在低温下进行的,最终得到的晶体是Cu(NO3)2•6H2O,故c错误;
d.由图象可以看出,溶液降温至30℃以下,可以析出Cu(NO3)2•6H2O晶体,故d正确,
故答案为:bd;
Ⅱ(4)Ag+(aq)+2NH3(aq)=Ag(NH3)2+(aq),该反应平衡常数的表达式=$\frac{c(Ag(N{H}_{3}{)_{2}}^{+})}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$,可逆反应AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数 K=$\frac{c(C{l}^{-})c(Ag(N{H}_{3}{)_{2}}^{+})}{{c}^{2}(N{H}_{3})}$=$\frac{c(C{l}^{-})c(Ag(N{H}_{3}{)_{2}}^{+})}{{c}^{2}(N{H}_{3})}$×$\frac{c(A{g}^{+})}{c(A{g}^{+})}$=Ksp(AgCl)×K稳=1.45×10-10×1.10×107=1.6×10-3,设溶解的AgCl物质的量为x,反应前后系数相同,可以用物质的量代替平衡浓度计算平衡常数,
AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq),
依据平衡常数=$\frac{c(C{l}^{-})c(Ag(N{H}_{3}{)_{2}}^{+})}{{c}^{2}(N{H}_{3})}$=$\frac{{x}^{2}}{(1-2x)^{2}}$=1.595×10-3,
1-2x≈1,计算得到x=0.04mol,
故答案为:$\frac{c(Ag(N{H}_{3}{)_{2}}^{+})}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$;1.6×10-3; 0.04.
点评 本题以工艺流程为载体,侧重化学基本概念、基本理论,考查了氧化还原反应及离子方程式的配平,水溶液中的离子平衡、沉淀溶解平衡等电解质溶液的相关知识,考查学生的知识运用能力、灵活分析处理实际问题的能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | S(s,单斜)═S(s,正交)△H3=+0.33 kJ•mol-1 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | ①式表示断裂1 mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量多297.16 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.6NA | |
| B. | 常温常压下,92g的NO2和N2O4的混合气体中含有的原子个数为6 NA | |
| C. | 用惰性电极电解食盐水,若电路中通过NA个电子,则阳极产生的气体体积一定为11.2L | |
| D. | 2.0gH218O与D2O的混合物中所含中子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的氢化物溶于水显酸性 | |
| B. | Z的氧化物的水化物一定是强酸 | |
| C. | Y的氧化物是离子化合物 | |
| D. | X和Z的最高价氧化物对应的水化物都是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3 | B. | H2SO4 | C. | NaOH | D. | Ba(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com