
| 分类组合 | 纯净物 | 强电解质 | 盐 | 碱性氧化物 | 分子式 |
| A | 碱石灰 | 氨水 | 纯碱 | 氧化铝 | S8 |
| B | 聚乙烯 | 碳酸钙 | 小苏打 | 氧化镁 | KCl |
| C | H2O2 | 硝酸 | 苏打 | 过氧化钠 | SiO2 |
| D | 无水硫酸铜 | 氯化银 | 碱式碳酸铜 | 氧化钠 | P4 |
| A. | A | B. | B | C. | C | D. | D |
分析 只由一种物质构成的是纯净物;碱性氧化物是指能和酸反应生成盐和水的氧化物;盐是指能电离出金属阳离子(铵根离子)和酸根阴离子的化合物;
强电解质是指在水溶液中或熔融状态下能完全电离的电解质,据此分析解答.
解答 解:A、碱石灰是氢氧化钠和氧化钙的混合物,氨水属于混合物,不是电解质,氧化铝是两性氧化物,故A错误;
B、聚乙烯是混合物,故B错误;
C、过氧化钠和酸反应生成氯化钠、水以及氧气,不是碱性氧化物,二氧化硅是原子晶体,SiO2不是其分子式,故C错误;
D、无水硫酸铜是纯净物,氯化银是盐,属于强电解质,碱式碳酸铜属于碱式盐,氧化钠和酸反应生成盐和水,属于碱性氧化物,白磷的分子式为:P4,故D正确.
故选D.
点评 本题考查了纯净物、碱性氧化物和酸性氧化物和强电解质的概念,根据概念的实质来分析,难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol | B. | 0.4 mol | C. | 0.6 mol | D. | 0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 答案 | 实验现象 |
| ①向鸡蛋清溶液里加入饱和硫酸铵溶液 | A.呈蓝色 B.呈黄色 C、析出白色沉淀 D.出现光亮的银镜 | |
| ②向银氨溶液中加人葡萄糖溶液后水浴加热 | ||
| ③向鸡蛋清溶液里滴加浓硝酸后微热 | ||
| ④向士豆片上滴加碘水 |
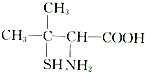
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
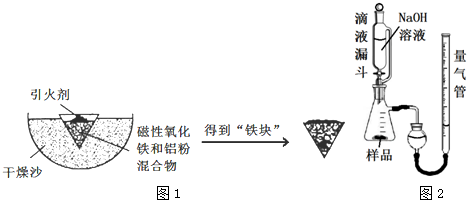
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色 | |
| B. | 聚氯乙烯塑料有毒,不可用于制食品包装袋 | |
| C. | 明矾溶于水生成的Al (OH)3胶体,可除去水中的悬浮颗粒等杂质 | |
| D. | 新制的Cu(OH)2可以测定糖尿病患者尿中萄葡糖的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
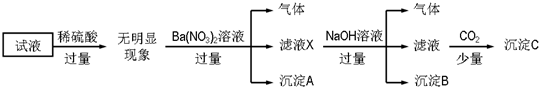
| A. | 沉淀A是BaSO4,说明原试液中一定含有SO42- | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe3+和Ba2+ | |
| C. | 沉淀C只有一种成分 | |
| D. | 原溶液中一定大量存在的离子只有:NH4+、Fe2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.1mol/L氨水与0.1 mol/L稀盐酸等体积混合:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| B. | 将pH=2 的稀盐酸与pH=12的氨水等体积混合,所得溶液pH>7 | |
| C. | 0.10 mol•L-1的氨水用HNO3溶液完全中和后,溶液显中性 | |
| D. | 用惰性电极电解稀硫酸时,实质是电解水,溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com