
从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是( )
A.此法的优点之一是原料来源丰富
B.第④步电解时阴极产生氯气
C.①②③步骤的目的是从海水中提取MgCl2
D.以上提取镁的过程中涉及化合、分解和复分解反应
科目:高中化学 来源: 题型:
下列各组离子在指定的溶液中,能大量共存的划“√”,不能大量共存的划“×”
(1)含有大量Fe3+的溶液:Na+、SCN-、Cl-、I-( )
(2)含有大量NO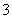 的溶液:H+、Fe2+、Cl-、SO
的溶液:H+、Fe2+、Cl-、SO ( )
( )
(3)常温下,pH=12的溶液:K+、Cl-、SO ( )
( )
(4)c(H+)=0.1 mol·L-1的溶液:Na+、NH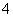 、SO
、SO 、S2O
、S2O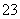 ( )
( )
(5)使pH试纸显蓝色的溶液:Cu2+、NO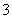 、Fe3+、SO
、Fe3+、SO ( )
( )
(6)与铝粉反应放出H2的无色溶液:NO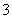 、Al3+、Na+、SO
、Al3+、Na+、SO ( )
( )
(7)使红色石蕊试纸变蓝的溶液:SO 、CO
、CO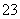 、Na+、K+( )
、Na+、K+( )
(8)常温下 =1×10-12的溶液:K+、AlO
=1×10-12的溶液:K+、AlO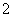 、CO
、CO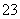 、Na+( )
、Na+( )
(9)中性溶液:Fe3+、Al3+、NO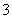 、SO
、SO ( )
( )
(10)使甲基橙变红色的溶液:Mg2+、K+、SO 、SO
、SO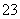 ( )
( )
(11)c(H+)水=10-12 mol·L-1的溶液:Na+、K+、CO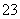 、SO
、SO ( )
( )
(12)使酚酞变红色的溶液:Na+、Cu2+、Fe2+、NO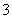 ( )
( )
(13)0.1 mol·L-1的Na2CO3溶液:Al3+、SO 、Cl-、K+( )
、Cl-、K+( )
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g)
ΔH=a kJ·mol-1
3AlCl(g)===2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为________________________________________________________________________。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2===17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是
________________________________________________________________________。
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为____________。
③在0.5 mol·L-1 NaOH和1.0 mol·L-1 MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质的X射线衍射谱图如图所示(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是__________(填化学式)。
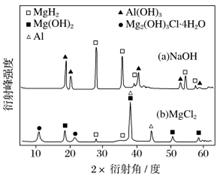
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是一种低毒金属元素,它并非人体需要的微量元素,食用后不会导致急性中毒,但食品中铝的含量超过国家标准就会对人体造成危害。下列关于铝元素的说法正确的是( )
A.铝在空气中不易氧化是因为其性质不活泼
B.氢氧化铝可与胃酸反应,常用作中和胃酸的药物
C.明矾可用于饮用水的杀菌消毒
D.硫酸铝铵常用作面粉膨化剂,该物质不溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
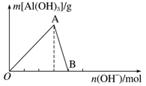
如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。
请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为__________。
(2)AB段曲线所表示的反应的离子方程式为___________________________________
________________________________________________________________________
________________________________________________________________________。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是___________________。
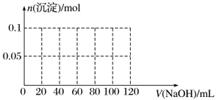
(4)向含有0.1 mol NH4Al(SO4)2溶液中逐滴加入5 mol·L-1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.带相反电荷的离子之间的相互吸引称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键
D.非金属原子间可能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为________。
(2)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为________________。
(3)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为________________。
(4)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com