
往100 mL氢离子浓度为1mol·L-1的硫酸和硝酸混合液中投入3.84 g铜粉,微热使反应充分完成后,生成NO气体448 mL(标准状况)。则反应前的混合液中含硫酸的物质的量为
A. 0.01mol B. 0.02 mol C. 0.03 mol D. 0.04 mol
科目:高中化学 来源: 题型:
已知反应A2(g)+2B2(g)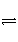
 2AB2(g) ΔH<0,下列说法正确的是( )
2AB2(g) ΔH<0,下列说法正确的是( )
A.升高温度有利于反应速率增加,从而缩短达到平衡的时间
B.升高温度,正向反应速率增加,逆向反应速率减小
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活、社会密切相关。下列说法不正确的是 ( )
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列物质中所含少量杂质的方法不正确的是(括号内的物质为杂质)( )
A.Cu粉(CuO):加稀硫酸、微热、过滤
B.乙醇(沸点为78℃)(NaCl):蒸馏
C.淀粉溶液(KI):渗析
D.KNO3溶液(I2):加酒精,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
化学为人类基本的生存需要、进而追求生活乃至生命质量的提升提供了重要的保障。但某些人的贪得无厌和对化学原理的滥用败坏了化学学科声誉,我们每个人都应该避免成为这样的人。下列科学史上的重要发现与发明,从原理上看与化学学科没有直接相关性的是
A、1774年舍勒最早制得氯气,1820年前后漂白粉用于饮用水消毒
B、1869年门捷列夫发现元素周期律,使元素的性质更有规律可循
C、1902年哈伯开始对合成氨反应进行研究,工业化后提高了粮食产量
D、1942年费米进行了235U原子核裂变试验,从而开创原子能利用时代
查看答案和解析>>
科目:高中化学 来源: 题型:
化学史上很多重要物质的发现背后都有科学家们的兴趣、坚持、创新与传承。例如氨的发现史,阅读下文并填空。
1727年,英国牧师、化学家哈尔斯用氯化铵与熟石灰的混合物在以水封闭的曲颈瓶中加热,只见水被吸入瓶中而不见气体放出;
(1)哈尔斯制氨气发生的反应方程式为 ,水吸入曲颈瓶的原理与 实验相同。氨的电子式为 ;
1774年英国化学家普利斯特里重作这个实验,采用汞代替水来密闭曲颈瓶,即排汞取气法,制得了碱空气(氨)。他还研究了氨的性质,他发现
(2)氨可以在纯氧中燃烧,已知该反应为一个置换反应,反应方程式为
,预期该反应在生产上 (填有或无)实际用途。
(3)在氨气中通以电火花时,气体体积在相同条件下增加很多,该反应的化学方程式是 ,据此证实了氨是氮和氢的化合物。其后戴维等化学家继续研究,进一步证实了氨的组成。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,下列叙述不是可逆反应A(g)+3B(g)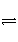
 2C(g)达到平衡状态标志的是( )
2C(g)达到平衡状态标志的是( )
①C生成的速率与C分解的速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④A、B、C的压强不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗a mol A,同时生成3a mol B
⑧A、B、C的分子数之比为1∶3∶2
A.②⑧ B.①⑥ C.②④ D.③⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的SO2和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2
 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是________(填字母)。
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是________(填字母)。
a.向装置中再充入N2
b.向装置中再充入O2
c.改变反应的催化剂
d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
查看答案和解析>>
科目:高中化学 来源: 题型:
在Na2CO3和HCl反应的下列各组实验中,反应速率最快的一组是( )
| 组号 | 温度(℃) | Na2CO3浓度(mol/L) | HCl浓度(mol/L) |
| A | 0 | 0.1 | 0.1 |
| B | 20 | 0.1 | 0.1 |
| C | 40 | 0.1 | 0.2 |
| D | 40 | 0.2 | 0.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com