
【题目】下列实验操作能达到实验目的的是
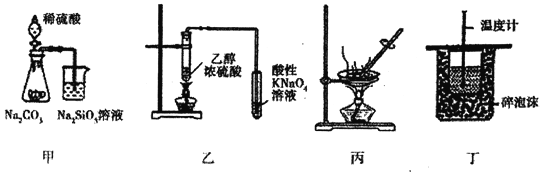
A. 图甲装罝可证明非金属性强弱:S>C>Si
B. 图乙装置可用于检验有乙烯生成
C. 图丙装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体
D. 图丁装置可用来测定中和热
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是:
A. 纤维素在人体内不能水解成葡萄糖,不能作为人类的营养物质,但可以帮助人消化
B. 二氧化硫能杀灭霉菌和细菌,可用作食物和干果的防腐剂
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 生吃新鲜蔬菜比熟吃蔬菜更有利于获取维生素C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业为人类解决粮食问题做出了巨大贡献。一定条件下,在密闭容器中进行合成氨反应:N2(g) + 3H2(g)![]() 2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是
2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是
A.N2、H2完全转化为NH3
B.N2、H2、NH3在容器中共存
C.反应已达到化学平衡状态
D.N2、H2、NH3的浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子序数与主要化合价的关系图,X、Y、Z、W、R是其中的五种元素。下列说法不正确的是

A. 原子半径:Y>X B. 最高价氧化物的水化物的酸性:R>W
C. 气态氢化物的稳定性:X>W D. 单质与水(或酸)反应的剧烈程度:Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对沉淀溶解平衡的描述正确的是( )
A. 反应开始时,溶液中各离子浓度相等
B. 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C. 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D. 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示;
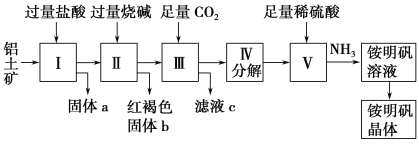
请回答下列问题:
(1)固体a的化学式为 ,Ⅲ中通入足量CO2气体发生反应的离子方程式为 。
(2)由Ⅴ制取铵明矾溶液的化学方程式为 ,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称) 、冷却结晶、过滤洗涤。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84 g·cm-1 L(保留一位小数)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表中前36号元素,核电荷数依次增大,A与B能形成种类繁多的化合物,D原子中成对电子数等于未成对电子数的3倍;E+中所有电子正好充满K、L、M三个电子层。
(1)基态C原子核外有_____种运动状态不同的电子,元素C的气态氢化物的空间构型为____。
(2)B、C、D三种元素的第一电离能由大到小的顺序为_________。(用元素符号表示)
(3)A与B形成的化合物B2A2中B原子的杂化方式为____,分子中含有的σ键和π键个数分别是______、_______。
(4)D与钠元素形成的原子数之比为l:1的物质中具有的化学键类型为______。
(5)E+与C的简单离子形成晶体的晶胞结构如图1所示,图中白球表示_______。
(6)E的单质晶体的晶胞结构如图2所示,其空间利用率为_____(圆周率用π表示,![]() )
)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是 。
(2)利用实验1数据计算,用KMnO4的浓度变化表示反应速率 v(KMnO4)= 。
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图乙所示。 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
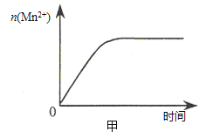
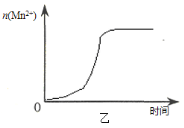
①该小组同学提出的假设是 。
②请你帮助该小组同学完成实验方案,并选表中空白处应加入的物质。
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
4 | 3.0 | 2.0 | 3.0 | 2.0 |
| |
A.KMnO4 B.H2C2O4 C.K2SO4 D.MnSO4
③若该小组同学提出的假设成立,应观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4﹒7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
![]()
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是________。
(2)0.10mol·L-1莫尔盐溶液中离子浓度由大到小的顺序为_________;
(3)常温下,若0.1 mol﹒L-1 (NH4)2SO4溶液的pH=5,求算NH3﹒H2O的电离平衡常数Kb=___________
(4)为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为c mol﹒L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数. | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | .25.52, | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为:_______________。滴定终点的现象是____________________。
通过实验数据计算的该产品纯度为_________(用字母ac表)。上表中第一次实验中记录数据明显大于后两次,其原因可能是____________(填符号)。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com