
【题目】甲醇是重要的化工原料,在有机合成中具有广泛应用。
(1)用甲醇制取甲胺的反应为:CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g)△H
已知该反应中相关化学键的键能数据如下:
共价键 | C―O | H―O | N―H | C―N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=______kJ·mol-1
(2)一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应:
主反应:CO(g)+2H2(g)CH3OH(g)△H<0 Ⅰ
副反应:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0 Ⅱ
反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)随温度、压强的变化如图所示:
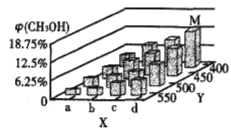
①图中a___b(填“大于”或“小于”)。图中Y轴表示温度,其理由是_________;
②若反应II的平衡常数K值变小,则下列说法中正确的是___________(填序号)。
A.平衡均向正反应方向移动 B.平衡移动的原因是升高了温度
C.达到新平衡后,φ(CH3OH)减小 D.容器中φ(CH3OCH3)增大
③平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为_____;用H2表示I的反应速率为_____mol·L-1·min-1。
(3)用NaOH溶液做CO2碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=11的溶液,则溶液中c(![]() )∶c(
)∶c(![]() )=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(
)=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(![]() )+2c(
)+2c(![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
【答案】-12 小于 随着Y值的增加,CH3OH的体积分数φ (CH3OH)减小,平衡逆向移动,若增大压强,平衡会正向移动,故Y表示温度 BC 56% ![]() 1:5
1:5
>
【解析】
(1)设C―H的键能为xkJ/mol,反应CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g)的△H=反应物总键能-生成物总键能=(3x+351+463+ 393×3- 3x- 293- 393×2-463×2)kJ/mol=-12 kJ/mol;
(2)①副反应反应前后气体分子数不变,若增大压强,主反应正向移动,CH3OH的体积分数增大,根据图示信息可判断,随着Y的增大CH3OH的体积分数减小,故X轴代表的是压强,X轴上a点的数值比b点小;随着Y值的增加,CH3OH的体积分数φ (CH3OH)减小,平衡逆向移动,若增大压强,平衡会正向移动,故Y表示温度;
②Ⅱ:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0,若反应Ⅱ的平衡常数K值变小,平衡常数只与温度有关,反应Ⅱ的正反应为放热反应,故平衡移动的原因是升高了温度,升高温度两个反应都逆向移动,容器中φ(CH3OCH3)减小,φ(CH3OH)也减小,所以正确的是BC;
③平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则n(CH3OCH3)=0.2mol,根据2CH3OH(g)CH3OCH3(g)+H2O(g),分解的CH3OH为0.4mol,生成的水为0.2 mol,设CO转化物质的量是x,则有:
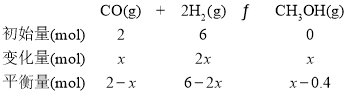
则![]() ,解得x=1.12mol,此时CO的转化率为;
,解得x=1.12mol,此时CO的转化率为;![]() ;用H2表示I的反应速率为:
;用H2表示I的反应速率为:![]() ;
;
(3)常温下,pH=11的溶液,其c(H+)=10-11mol/L,c(OH-)=10-3mol/L,由![]() +H2O
+H2O![]()
![]() +OH-得,根据溶液
+OH-得,根据溶液![]() ,代入相关数据可计算出溶液中c(
,代入相关数据可计算出溶液中c(![]() )∶c(
)∶c(![]() )=1:5,由电荷守恒原理得:c(Na+)+c(H+)=c(
)=1:5,由电荷守恒原理得:c(Na+)+c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH-),由于c(OH-)>c(H+),所以c(Na+)> c(
)+c(OH-),由于c(OH-)>c(H+),所以c(Na+)> c(![]() )+2c(
)+2c(![]() )。
)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nsnnpn |
B | 基态原子中的未成对电子数是同周期中最多的 |
C | 原子最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)E元素在周期表中的位置是_________________________。
(2)写出D元素基态原子的简化电子排布式:__________。
(3)这5种元素中电负性最大的元素是__________(填元素符号),A、B、C三种元素的第一电离能由大到小的顺序为_______________________(填元素符号)。
(4)B、C、D的简单离子的半径由大到小的顺序为____________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
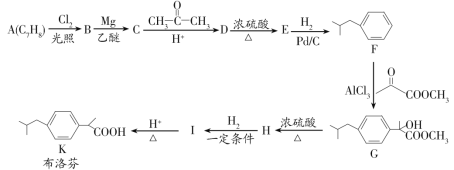
【题目】布洛芬具有降温和抑制肺部炎症的双重作用。一种制备布洛芬的合成路线如图:
已知:①CH3CH2Cl![]() CH3CH2MgCl
CH3CH2MgCl
②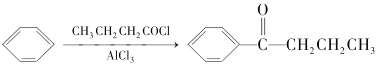 +HCl
+HCl
回答下列问题:
(1)A的化学名称为___,G→H的反应类型为___,H中官能团的名称为__。
(2)分子中所有碳原子可能在同一个平面上的E的结构简式为__。
(3)I→K的化学方程式为___。
(4)写出符合下列条件的D的同分异构体的结构简式__(不考虑立体异构)。
①能与FeCl3溶液发生显色反应;②分子中有一个手性碳原子;③核磁共振氢谱有七组峰。
(5)写出以间二甲苯、CH3COCl和(CH3)2CHMgCl为原料制备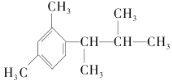 的合成路线:__(无机试剂任选)。
的合成路线:__(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在给定条件下一定能大量共存的是
A.强酸性溶液中:H+、NO![]() 、SO
、SO![]()
B.pH=12的溶液中:OH-、K+、Cl-、HCO![]()
C.加入铝粉能放出氢气的溶液中一定存在:NH![]() 、NO
、NO![]() 、AlO
、AlO![]() 、SO
、SO![]()
D.25C时pH=7的无色溶液中:Na+、Cl-、SO![]() 、K+
、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 纤维素、花生油、蚕丝在一定条件下都能发生水解反应
B. 煤的干馏是化学变化,煤的气化、液化和石油的分馏都是物理变化
C. 新戊烷用系统命名法命名为2,2-二甲基戊烷
D. 正四面体烷(![]() )与立方烷(
)与立方烷(![]() )的二氯代物数目相同
)的二氯代物数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,22.4 L Cl2溶于水充分反应转移NA个电子
B. 标准状况下,2.24 L HF与1.6 g CH4分子所含电子数目均为NA
C. 50 g质量分数为46%的乙醇溶液中氢原子总数为6NA
D. 25 ℃时,1 L 2 mol/L NH4Cl溶液和1 L 1 mol/L (NH4)2SO4溶液中所含NH4+的数目均为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)某二价金属离子有9个价电子,价电子的能级为3d。该元素位于周期表中的第四周期、第______族。
(2)在氰酸钾(KOCN)的组成元素中,第一电离能最大的是______(填元素符号、下同)、电负性最小的是______;其中阴离子的空间结构是______,C的杂化方式为______。
(3)乙二胺能与Mg2+离子形成稳定环状离子:[Mg(C2H8N2)2]2+,其结构如图所示:
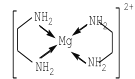
则该环状离子中镁离子的配位数为______。
(4)已知阿伏加德罗常数为NA,立方硫化锌(M=97g/mol)晶胞如图所示:
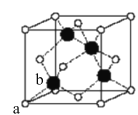
其晶胞棱长为δpm、则其密度为______g/cm3(用含δ的代数式表示);其中顶点位置a的S2-离子与其相邻位置b的Zn2+离子之间的距离为______pm(用含δ的代数式表示)。a位置的S2-离子和b位置的Zn2+离子的分数坐标依次为:______、______。(已知:1m=102cm=1012pm)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用与反应原理设计不一致的是( )
A.热的纯碱溶液清洗油污:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-
+OH-
B.明矾净水:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
C.用TiCl4制备TiO2:TiCl4+(x+2)H2O(过量) ![]() TiO2xH2O↓+4HCl
TiO2xH2O↓+4HCl
D.配制氯化亚锡溶液时加入氢氧化钠:SnCl2+H2O![]() Sn(OH)Cl+HCl
Sn(OH)Cl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如下图所示装置探究钢铁的腐蚀与防护,烧杯内液体均为饱和食盐水。
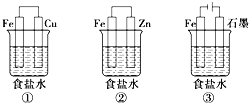
①在相同条件下,三组装置中铁电极腐蚀最快的是__(填装置序号),该装置中正极反应式为__。
②为防止金属Fe被腐蚀,可以采用上述___(填装置序号)装置原理进行防护。
(2)通信用磷酸铁锂电池有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-+Li+=LiM1-xFexPO4,其原理如图所示。
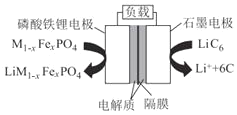
①放电时,电流由___电极经负载流向___电极;负极反应式为____。
②该电池工作时Li+移向___电极;充电时石墨电极接电源的____极。
③该电池的总反应方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com