
【题目】反应4NH3+5O2![]() 4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是( )
4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是( )
A.v(NH3)=0.002mol·L-1·s-1B. v(NO)=0.008mol·L-1·s-1
C. v(H2O)=0.015mol·L-1·s-1D. v(O2)=0.01mol·L-1·s-1
【答案】A
【解析】
v(NO)=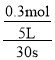 =0.002mol·L-1·s-1,因为同一反应中,用不同物质表示的平均反应速率之比等于化学计量数之比,因此,可由v(NO),求出其它物质表示的平均反应速率。
=0.002mol·L-1·s-1,因为同一反应中,用不同物质表示的平均反应速率之比等于化学计量数之比,因此,可由v(NO),求出其它物质表示的平均反应速率。
A.v(NO)=0.002mol·L-1·s-1,则v(NH3)=0.002mol·L-1·s-1,A正确;
B.由上面计算可知,v(NO)=0.002mol·L-1·s-1,B不正确;
C.v(NO)=0.002mol·L-1·s-1,则v(H2O)=0.003mol·L-1·s-1,C不正确;
D. v(NO)=0.002mol·L-1·s-1,则v(O2)=0.0025mol·L-1·s-1,D不正确;
故选A。


科目:高中化学 来源: 题型:
【题目】下列关于金属保护的说法不正确的是 ( )
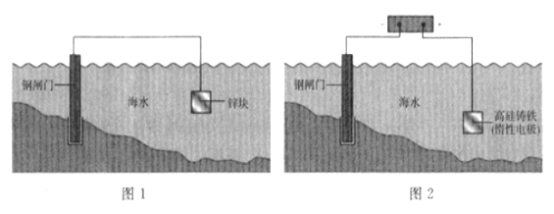
A. 图1是牺牲阳极阴极保护法,图2是外加电流阴极保护法
B. 钢闸门均为电子输入的一端
C. 锌和高硅铸铁的电板反应均为氧化反应
D. 两图所示原理均发生了反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2(不溶于水和酸)、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
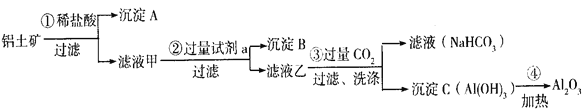
(1)沉淀A、B的成分分别是__________、__________;步骤②中的试剂a是__________;(以上均填化学式)
(2)试写出步骤③中发生反应的离子方式__________、__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下面实验装置设计实验制备SO2并进行相关探究活动。
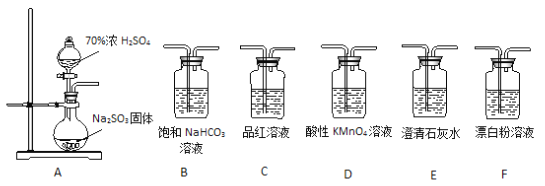
(1)装置A中反应的化学方程式为________________________。
(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→_________→_________→C→F。
(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置。则C装置的作用是________________________,通过______________________现象即可证明亚硫酸酸性强于碳酸。
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_________。
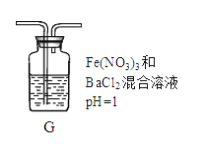
推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO3―氧化;
原因二:SO2被Fe3+氧化;
原因三:__________________。
若是原因二,需证明Fe3+的还原产物,其实验操作及现象是________________________。
(5)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0 g Na2SO3样品,配成250 mL溶液,取25.00 mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00 mL。达到滴定终点时锥形瓶中溶液颜色变化是______________,样品中Na2SO3质量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、人类生产、社会可持续发展密切相关,下列说法正确的是( )
A.合成材料、光伏材料和复合材料都是新型无机非金属材料
B.晋代![]() 抱扑子
抱扑子![]() 中记载有“丹砂烧之成水银,积变又还成丹砂”是指加热时丹砂
中记载有“丹砂烧之成水银,积变又还成丹砂”是指加热时丹砂![]() 熔融成液态,遇冷又重新凝结成HgS晶体
熔融成液态,遇冷又重新凝结成HgS晶体
C.煤的干馏是化学变化,煤的气化、液化和石油的分馏都是物理变化
D.![]() 本草经集注
本草经集注![]() 中记载了区别硝石
中记载了区别硝石![]() 和朴硝
和朴硝![]() 的方法:“以火烧之,紫青烟起,乃真硝石也”这是运用了“焰色反应”的原理
的方法:“以火烧之,紫青烟起,乃真硝石也”这是运用了“焰色反应”的原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨N2+3H2![]() 2NH3反应过程中的能量变化如图所示,据图回答下列问题:
2NH3反应过程中的能量变化如图所示,据图回答下列问题:

(1)该反应通常用活性铁作催化剂,加活性铁会使图中B点升高还是降低________________,理由是___________________________________________。
(2)该反应的平衡常数表达式为:K=___________________,当浓度商Qc___K(填“<”、“>”或“=”)时,反应向右进行。
(3)450 ℃时该反应的平衡常数___500 ℃时的平衡常数(填“<”、“>”或“=”)。
(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的合理措施有___(填字母序号)。
a.高温高压
b.加入催化剂
c.增加N2的浓度
d.增加H2的浓度
e.分离出NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物很多,利用所学物质结构与性质的知识去认识和理解它们。
(1)溴的核外电子排布式为__。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合作用力是___。
(3)下列曲线表示卤族元素某种性质随核电荷数递增的变化趋势,正确的是___。

(4)已知高碘酸有两种形式,化学式分别为H5IO6(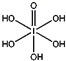 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6___HIO4(填“>”、“<”或“=”)。IO
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6___HIO4(填“>”、“<”或“=”)。IO![]() 的VSEPR模型为__。
的VSEPR模型为__。
(5)铜与氯形成化合物的晶胞如附图所示(黑点代表铜粒子)。

①该晶体的化学式为__。
②一定条件下,Cu2O比CuO更稳定的原因是__。
③已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体的边长为__pm。(用含ρ、NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na++HSO4-
B.H2SO4溶液与NaOH溶液发生中和反应的热化学方程式为(已知H2SO4 溶液与NaOH溶液发生反应的中和热为57.3 kJ/mol):H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H=-57.3kJ/mol
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的沉淀溶解平衡方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.隔绝空气高温加热生物质,通过热化学转换可产生可燃性气体
B.光![]() 电转换的途径必定是发生了化学反应
电转换的途径必定是发生了化学反应
C.开发太阳能、氢能、核能、天然气等新能源可以减少霾的产生
D.植物秸秆发酵制沼气是在有氧条件下进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com