
���и�����������Ӧ���������ܴ���������ǣ�������
| �� | A�� | ��c��H+��/c��OH����=1��10��14����Һ�У�NH4+��Ca2+��Cl����K+ |
| �� | B�� | ˮ�����c��H+��=10��13mol•L��1����Һ�У�Fe3+��SO42����K+��SCN�� |
| �� | C�� | ��c��H+��=10��14mol/L����Һ�п��ܺ���Na+��AlO22����CO32����SO32�� |
| �� | D�� | c��OH����=1��10��14mol/L����Һ�У�Na+��K+��Cl����S2O32�� |
| ���ӹ������⣮. | |
| ������ | A����c��H+��/c��OH����=1��10��14����Һ������������Ũ��Ϊ1mol/L��笠����ӡ������������������ӷ�Ӧ�� B��ˮ�����c��H+��=10��13mol•L��1����ҺΪ���Ի������Һ�������������������ӡ���������ӷ�Ӧ�� C����c��H+��=10��14mol/L����Һ�У�����������Ũ��Ϊ1mol/L��Na+��AlO22����CO32����SO32������֮�䲻������Ӧ�����������������ӷ�Ӧ�� D��c��OH����=1��10��14mol/L����Һ��������Ũ��Ϊ1mol/L���������������������ӷ�Ӧ�� |
| ��� | �⣺A����c��H+��/c��OH����=1��10��14����Һ�У�����ˮ�����ӻ������֪������������Ũ��Ϊ1mol/L��NH4+��Ca2+���������������ӷ�Ӧ������Һ�в��ܴ������棬��A���� B��ˮ�����c��H+��=10��13mol•L��1����Һ�д��ڴ��������ӻ����������ӣ�Fe3+��OH����SCN�����ӷ�Ӧ������Һ�в��ܴ������棬��B���� C����c��H+��=10��14mol/L����ҺΪ������Һ����Һ������������Ũ��Ϊ1mol/L��Na+��AlO22����CO32����SO32������֮�䲻������Ӧ���Ҷ��������������ӷ�Ӧ������Һ���ܹ��������棬��C��ȷ�� D������ҺΪ������Һ����Һ��������Ũ��Ϊ1mol/L��S2O32����������Һ�������ӷ�Ӧ�������ʺͶ����������壬����Һ�в��ܴ������棬��D���� ��ѡC�� |
| ������ | ���⿼�����ӹ���������жϣ�Ϊ�߿��еĸ�Ƶ�⣬��Ŀ�Ѷ��еȣ�ע����ȷ���Ӳ��ܴ��������һ��������磺�ܷ������ֽⷴӦ������֮�䣻 �ܷ���������ԭ��Ӧ������֮�䣻�ܷ�����Ϸ�Ӧ������֮�䣨�� Fe3+�� SCN�����ȣ�������ӹ�������ʱ��Ӧ��ע����Ŀ���������������磺��Һ������ԣ��ݴ����ж���Һ���Ƿ��д����� H+��OH������Һ����ɫ������ɫʱ���ų� Cu2+��Fe2+��Fe3+��MnO4������ɫ���ӵĴ��ڣ���Һ�ľ��巴Ӧ�������硰������ԭ��Ӧ�������������۲����������� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������У����ڴ��������(����)
A������������������������ B����ͭ
C��Ư�� D������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��״���£���6.72L CH4��3.01��1023HCl ��23.1g CCl4��2.3g Na�����ж��������ʵĹ�ϵ��С�����ʾ��ȷ���ǣ�������
| �� | A�� | ��� �ܣ��٣��ڣ��� | B�� | �ܶ� �٣��ܣ��ۣ��� |
| �� | C�� | ԭ���� �ܣ��ۣ��ڣ��� | D�� | ���� �ܣ��٣��ۣ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͬ�����£�O4���������һλ��ѧ�Һϳɵ�һ�����͵������ӣ�һ���������ĸ���ԭ�ӹ��ɣ��ᷢ����ը������ͬ�����£����ڵ�������O4��O3�Ƚ���ȷ���ǣ�������
| �� | A�� | ����ԭ������� | B�� | �ܶ�֮��1��1 | C�� | ���֮��1��1 | D�� | ������֮��4��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Һ�е�c��Cl������100mL 1mol•L��1�Ȼ�����Һ�е�c��Cl������ȣ�������
| �� | A�� | 300ml 1mol•L��1 �Ȼ�����Һ | B�� | 150ml 2mol•L��1�Ȼ����Һ |
| �� | C�� | 75ml 3mol•L��1 �Ȼ�����Һ | D�� | 120ml 1.5mol•L��1 �Ȼ�þ��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�о���ѧϰС����ʵ��������ͼ��ʾװ��̽�����������������ռ���Һ�ķ�Ӧ��ʵ������н���ͷ�ι��е�Һ�強����ƿ������Һ�ɿ��١�������ղ����ĵ����������塣����������ȷ����(����)
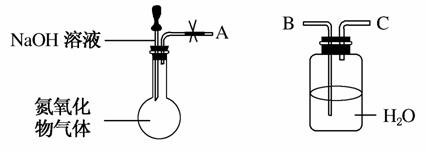
A������A��B���ӣ���ֹˮ�У�����ƿ�г����ܿ������ݲ���
B������A��C���ӣ���ֹˮ�У�ˮ�ص����ɹ��ƿ������ƿ��
C������A����B����C����ֹˮ�У�������������
D������NaOH��Һ��Ϊˮ������������װ����֤����������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͭ�Ͻ�㷺���ں��չ�ҵ�����и�����л��������Ʊ�ͭ������Ʒ�Ĺ������£�

(ע��Al(OH)3��Cu(OH)2��ʼ�ֽ���¶ȷֱ�Ϊ450 ���80 ��)
(1)��⾫����ʱ��������ӦʽΪ__________________������A��ϡHNO3��Ӧ�������������ڿ�����Ѹ�ٱ�Ϊ����ɫ���������ɫ�Ļ�ѧ��Ӧ����ʽΪ________________________________________________________ ________________________________________________________________________________________��
(2)��������B�����Ϊ________�������ɹ���B�Ĺ����У������NaOH�ļ���������NaOH�����������������ķ�Ӧ�����ӷ���ʽΪ________________________________________________________________________��
(3)������չ�����һ����Ӧ�Ļ�ѧ����ʽ��________CuO��______Al2O3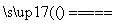 ______CuAlO2��______����
______CuAlO2��______����
(4)����ͭ�Ͻ���ͭ����������Ϊ63.5%��������5.0 kg�����е�ͭ����ȫת��Ϊ________mol CuAlO2��������Ҫ1.0 mol·L��1��Al2(SO4)3��Һ________L��
(5)CuSO4��ҺҲ�������Ʊ������������������________�����ˡ�ϴ�Ӻ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ�������Ͻ��������������У����ù�����NaOH��Һ�������������ij������ˡ�ϴ�ӡ�������պ�ʣ������ĩ��������ԭ�Ͻ�����ǡ����ȣ���Ͻ������ĺ���Ϊ�� ��
A��70% B��30% C��47.6% D��52.4%
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com