
【题目】根据下列实验操作和现象所得到的结论不正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向苯酚浊液中加入Na2CO3溶液,溶液变澄清 | 酸性:苯酚>HCO |
B | 用pH计测定等浓度的Na2CO3和NaClO溶液的pH | 后者pH比前者的大 |
C | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH<H2O |
D | 在2 mL 0.01 mol·L-1的Na2S溶液中先滴入几滴0.01 mol·L-1 ZnSO4溶液有白色沉淀生成,再滴入0.01 mol·L-1 CuSO4溶液,又出现黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
A. AB. BC. CD. D
【答案】BD
【解析】
A. 向苯酚浊液中加入Na2CO3溶液,反应生成苯酚钠和碳酸氢钠,说明酸性:苯酚>HCO![]() ,故A正确;
,故A正确;
B.酸性HClO>HCO3-,则等浓度的Na2CO3和NaClO溶液碱性Na2CO3大于NaClO,用pH计测定等浓度的Na2CO3和NaClO溶液的pH,后者pH比前者的小,故B错误;
C. 钠与乙醇反应平缓,钠与水反应剧烈,说明羟基中氢的活性:C2H5OH<H2O,故C正确;
D. 在2 mL 0.01 mol·L-1的Na2S溶液中先滴入几滴0.01 mol·L-1 ZnSO4溶液有白色沉淀生成,再滴入0.01 mol·L-1 CuSO4溶液,又出现黑色沉淀,因为Na2S溶液过量,均为沉淀的生成,所以不能比较Ksp(CuS)、Ksp(ZnS)的大小,故D错误。
答案选BD。


科目:高中化学 来源: 题型:
【题目】迄今为止,煤、石油和天然气等化石能源仍然是人类使用的主要能源。下列有关煤、石油、天然气等资源的说法正确的是
A. 石油裂解可以得到汽油,这种汽油是一种纯净物
B. 煤的气化就是将煤在高温条件由固态转化为气态的变化过程
C. 天然气是一种清洁的化石燃料
D. 煤就是碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用氢气与氯气的的反应生产盐酸。
若一定量氢气在氯气中燃烧,所得混合物用100mL 3.0mol/L NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含NaClO的物质的量为0.0500mol。
(1)写出氯气与氢氧化钠溶液反应的化学方程式______________________。
(2)原NaOH溶液的质量分数为_____________________________。(保留三位小数)
(3)所得溶液中Cl-的物质的量为____________________________。
(4)求所用氯气和参加反应的氢气的物质的量之比____________________________。(写出计算过程)
(5)若将H2和Cl2充分混合后,在光照条件下会发生爆炸。现取一份H2和Cl2组成的混合气体经光照充分反应后,通入1000mL 0.1mol/L的NaOH溶液中,如图表示某种离子的物质的量随通入气体的体积变化曲线。当n=0.02mol时,光照前的混合气体中H2和Cl2的物质的量之比为________(已知HClO为弱酸,在水中主要以分子形式存在)
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表达中不正确的是
A. 4Be2+中的电子数和质子数之比一定为1:2
B. D216O中,质量数之和是质子数之和的两倍
C. 在氮原子中,质子数为7而中子数不一定为7
D. Cl-的结构示意图为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行下列反应:M(g)+N(g)==R(g)+2L。此反应符合下列图象,R%为R在平衡混合物中的体积分数,该反应是

A. 正反应为吸热反应 L是气体
B. 正反应为放热反应 L是气体
C. 正反应为吸热反应 L是固体
D. 正反应为放热反应 L是固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对3A2(g)+B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的

A. a、b、c三点平衡常数的大小关系为:Kb>Kc >Ka
B. 达到平衡时B2的转化率大小为:b>a>c
C. 增大压强有利于AB3的生成,因此在实际生产中压强越大越好
D. 若起始量为![]() ,则在T2温度下,平衡时AB3的体积分数接近b点
,则在T2温度下,平衡时AB3的体积分数接近b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常见物质间的转化关系,其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物,其中A常温下呈液态;B和E为能产生温室效应的气体,且1mol E中含有10mol电子。乙和丁为黑色固体,将他们混合后加热发现固体由黑变红。

(1)写出化学式:甲______;乙______;丙______;
(2)丁的摩尔质量______;
(3)写出丙和E反应生成A和B的化学方程式___________;
(4)有同学将乙和丁混合加热后收集到的标准状态下气体4.48L,测得该气体是氢气密度的16倍,若将气体通入足量澄清石灰水,得到白色沉淀物___g;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.4 mol某气体的体积为9.8L,则该气体的摩尔体积为_____。
(2)标准状况下,测得1.92克某气体的体积为672mL,则此气体的相对分子质量为___。
(3)实验室用Na2CO3·10H2O晶体配制0. 5mol/L的Na2CO3溶液970mL,应称取Na2CO3·10H2O的质量是____。
(4)某学生欲用12mol·L-1浓盐酸和蒸馏水配制500 mL 0.3 mol·L-1的稀盐酸。
①该学生需要量取____mL上述浓盐酸进行配制。
②下列实验操作会导致所配制的稀盐酸的物质的量浓度偏小的是____(填序号)。
a.用量筒量取浓盐酸时俯视观察凹液面
b.将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中
c.稀释浓盐酸时,未冷却到室温即转移到容量瓶中
d. 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
e.容量瓶洗涤干净后未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2在生产、生活中有着广泛的用途。
(1)请你列举一个SO2在生活中的用途:______________________。
(2)SO2在工业上常用于硫酸生产:2SO2(g)+O2(g)![]() 2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为__________________。
2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为__________________。
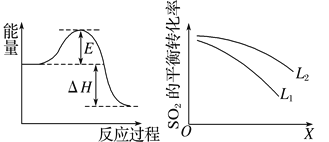
(3)上图中L、X表示物理量温度或压强,依据题中信息可判断:
①X表示的物理量是_________________________,
②L1________(填“>”“<”或“=”)L2。
(4)在容积固定的密闭容器中,起始时充入0.2molSO2和0.1molO2,反应体系起始总压强为0.1MPa。反应在一定的温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极的电极反应式:__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com