
在一定温度下,反应

 达到平衡的标志是
达到平衡的标志是
[ ]
A.单位时间内生成nmol 的同时生成nmolAB
的同时生成nmolAB
B.容器内的总压强不随时间的变化而变化
C.单位时间内生成2nmolAB同时生成nmol
D.单位时间内生成nmol 同时生成nmol
同时生成nmol
|
化学平衡状态的标志是  ,平衡混合物中各组分的农度或百分含量保持不变.因此,判断可逆反应是否达到平衡状态的依据较多,如以正、逆反应为依据时应看清两点,一是是否有 ,平衡混合物中各组分的农度或百分含量保持不变.因此,判断可逆反应是否达到平衡状态的依据较多,如以正、逆反应为依据时应看清两点,一是是否有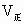 、 、 ,二是它们的数值是否相等,两者缺一不可.如以反应前后组分的浓度或百分含量为依据时,应注意反应的特征,即看反应式两边气体分子数是否相等. ,二是它们的数值是否相等,两者缺一不可.如以反应前后组分的浓度或百分含量为依据时,应注意反应的特征,即看反应式两边气体分子数是否相等.
选项 A中单位时间内生成nmol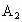 相当于逆反应速率,生成nmolAB相当于正反应速率,由反应式可知,当生成nmol 相当于逆反应速率,生成nmolAB相当于正反应速率,由反应式可知,当生成nmol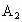 的同时如果生成了2nmolAB,可表示正、逆反应速率相等,所以选项A错误.同理分析可得选项C正确.选项D均表示了逆反应速率,无论反应是否达到了平衡,选项D一定能成立,因而它不能作为判断反应是否达到了平衡的依据.由反应式可知,该反应是一个两边气体分子数相等的反应,如容器体积不变,无论反应是否达到平衡,容器内气体的总压强总是恒定不变的,所以压强是否变化不能作为该反应是否达到平衡的依据.本题正确答案为C. 的同时如果生成了2nmolAB,可表示正、逆反应速率相等,所以选项A错误.同理分析可得选项C正确.选项D均表示了逆反应速率,无论反应是否达到了平衡,选项D一定能成立,因而它不能作为判断反应是否达到了平衡的依据.由反应式可知,该反应是一个两边气体分子数相等的反应,如容器体积不变,无论反应是否达到平衡,容器内气体的总压强总是恒定不变的,所以压强是否变化不能作为该反应是否达到平衡的依据.本题正确答案为C. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| H | + 4 |
| O | - 2 |
| H | + 4 |
查看答案和解析>>
科目:高中化学 来源:名卷汇编(化学) 题型:021
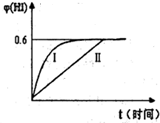
将1mol一氧化碳和1mol水蒸气放入一固定容积的密闭容器中,发生如下反应: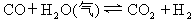
在一定温度下,反应达平衡后,得到0.6mol二氧化碳,再加入2mol水蒸气并在相同条件下达新平衡后,下列叙述正确的是
[ ]
A.一氧化碳的转化率提高,水蒸气的转化率降低
B.反应物的转化率都提高
C.平衡向正反应方向移动,二氧化碳在平衡混合气中的体积分数增大
D.平衡向正反应方向移动,二氧化碳的平衡浓度增大
查看答案和解析>>
科目:高中化学 来源:2004全国各省市高考模拟试题汇编·化学 题型:021
在一定温度下,将1mol一氧化碳和1mol水蒸气放入一固定容积的密闭容器中,发生如下反应:CO+H2O(g) CO2+H2;在一定温度下,反应达平衡后,得到0.6mol二氧化碳,再加入2mol水蒸气并在相同条件下达新平衡后,下列叙述正确的是
CO2+H2;在一定温度下,反应达平衡后,得到0.6mol二氧化碳,再加入2mol水蒸气并在相同条件下达新平衡后,下列叙述正确的是
[ ]
A.一氧化碳的转化率提高,水蒸气的转化率降低
B.反应物的转化率都提高
C.平衡向正反应方向移动,二氧化碳在平衡混合气中的体积分数增大
D.平衡向正反应方向移动,二氧化碳的平衡浓度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com