
 利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下: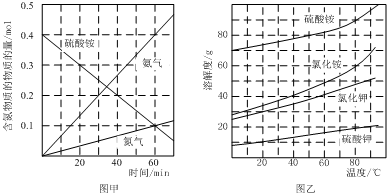
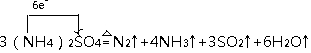 .
.分析 (1)①根据盖斯定律,给已知方程式编号①SO2(g)+NH3•H2O(aq)═NH4HSO3(aq)△H1=a kJ•mol-1;②NH3•H2O(aq)+NH4HSO3(aq)═(NH4)2SO3(aq)+H2O(l)△H2=b kJ•mol-1;③2(NH4)2SO3(aq)+O2(g)═2(NH4)2SO4(aq)△H3=c kJ•mol-1;目标反应的反应热为:①×2+②×2+③,由此分析解答;
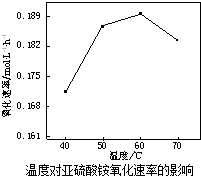
(2)根据图1分析,60℃氧化速率最快,温度过高(NH4)2SO3会分解;
(3)反应的离子方程式为CaSO4(s)+CO32-(aq)?SO42-(aq)+CaCO3(s),该反应的平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$×$\frac{c(C{a}^{2+})}{c(C{a}^{2+})}$=$\frac{Ksp(CaS{O}_{4})}{Ksp(CaC{O}_{3})}$;
(4)①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气和水,结合原子守恒配平书写化学方程式;
②在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示,硫酸铵分解生成氮气、氨气、二氧化硫和水,结合电子守恒和原子守恒配平书写;
③(NH4)2SO4是工业制备K2SO4的重要原料.根据图乙中相关物质的溶解度曲线,从生成物的溶解度大小考虑反应能否发生;
解答 解:(1)①根据盖斯定律,给已知方程式编号①SO2(g)+NH3•H2O(aq)═NH4HSO3(aq)△H1=a kJ•mol-1;
②NH3•H2O(aq)+NH4HSO3(aq)═(NH4)2SO3(aq)+H2O(l)△H2=b kJ•mol-1;
③2(NH4)2SO3(aq)+O2(g)═2(NH4)2SO4(aq)△H3=c kJ•mol-1;
盖斯定律计算目标反应的反应热为:①×2+②×2+③,2SO2(g)+4NH3•H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)△H=(2a+2b+c)KJ/mol,
故答案为:2a+2b+c;
(2)根据图1分析,60℃氧化速率最快,则在空气氧化(NH4)2SO3的适宜温度为60℃,温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中溶解度降低),
故答案为:温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中溶解度降低);
(3)反应的离子方程式为CaSO4(s)+CO32-(aq)?SO42-(aq)+CaCO3(s),该反应的平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$×$\frac{c(C{a}^{2+})}{c(C{a}^{2+})}$=$\frac{Ksp(CaS{O}_{4})}{Ksp(CaC{O}_{3})}$=$\frac{9.1×1{0}^{-6}}{2.9×1{0}^{-9}}$=3138,
故答案为:3138;
(4)①将黄铜精矿主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气和水,结合电子守恒和原子守恒配平书写,反应的化学方程式为:2Cu2S+2(NH4)2SO4+5O2$\frac{\underline{\;\;△\;\;}}{\;}$4CuSO4+4NH3+2H2O,
故答案为:2Cu2S+2(NH4)2SO4+5O2$\frac{\underline{\;\;△\;\;}}{\;}$4CuSO4+4NH3+2H2O;
②在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示,硫酸铵分解生成氮气、氨气、二氧化硫和水,结合电子守恒和原子守恒配平书写得到化学方程式为:3(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+4NH3↑+3SO2↑+6H2O↑,氮元素化合价-3价变化为0价,硫元素化合价+6价变化为+4价,电子转移总数6e-,
单线桥标出电子转移的方向及数目为: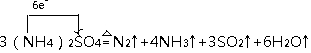 ,
,
故答案为: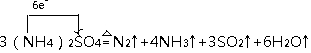 ;
;
③根据复分解反应发生的条件和图象中物质溶解度分析,常温下K2SO4的溶解度小,在生成物中会以沉淀的形式出现,故反应可以进行,工业上制备K2SO4晶体的设计思路是:配制较高温度(80℃-100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤得到,
故答案为:配制较高温度(80℃-100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤;
点评 本题考查了热化学方程式和盖斯定律计算应用、图象分析和条件选择、氧化还原反应和产物的判断、物质溶解度不同得到人晶体的方法等知识点,掌握基础是解题关键,题目难度中等.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 混合气体的颜色不再变化 | B. | 混合气体的压强不再变化 | ||
| C. | 反应速率v(H2)=$\frac{1}{2}$v(HI) | D. | c(H2):c(I2):c(HI)=1:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入先加氯水,再加KSCN溶液后显红色,该溶液中一定含Fe2+ | |
| B. | 向某溶液中加入硝酸酸化的硝酸银溶液,出现白色沉淀,该溶液中一定含Cl- | |
| C. | 向某溶液中加入盐酸酸化的氯化钡溶液,出现白色沉淀,该溶液中一定含SO42- | |
| D. | 向某溶液中加入稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液中一定含CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,11.2LNO与11.2LO2混合后气体分子数为0.75NA | |
| B. | 7.8gNa2O2与足量的CO2反应时转移的电子数为0.2NA | |
| C. | 1L 1 mol/L的醋酸溶液中所含离子总数为2NA | |
| D. | 常温常压下,16gO3所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
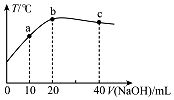 在一隔热系统中,向20.00mL 0.01000mol•L-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )
在一隔热系统中,向20.00mL 0.01000mol•L-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )| A. | 若a点溶液呈酸性,则a点有:c(CH3COO-)>c(Na+)>c(CH3COOH) | |
| B. | 从b到c:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | 水的电离程度:b点<c点 | |
| D. | b点有0.01000mol•L-1+c(H+)=c(Na+)-c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:
二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:| 化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
| E/(kJ.mol-1) | 436 | 343 | 465 | 453 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
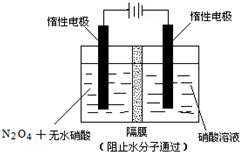 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
N2O5是一种新型硝化剂,其性质和制备受到人们的关注. .
.| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质钠放入水中,产生气体:Na+H2O═Na++OH-+H2↑ | |
| B. | 单质铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | AlCl3溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | Ca(HCO3)2溶液中加入少量NaOH:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.2mol•L-1的NH4Cl溶液与NaOH溶液混合,c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 仅含有Na+、H+、OH-、CH3COO-四种离子的某溶液中可能存c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | 常温下,pH=2的醋酸与pH=12的氢氧化钠等体积混合后,混合液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 将pH=8.5的氨水加水稀释后,溶液中所有离子的浓度均降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com