
【题目】有下列8种物质,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
①甲烷 ②苯 ③聚乙烯 ④1,3-丁二烯 ⑤2-丁炔 ⑥邻二甲苯 ⑦乙醛 ⑧环己烯
A. ③④⑤⑧ B. ④⑤⑦⑧ C. ④⑤⑧ D. ③④⑤⑦⑧
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应的熵一定增大,非自发反应的熵一定减小或不变
C.△H<0、△S<0的反应一定能自发进行
D.△H>0、△S<0的反应一定不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;②Cm-、E(m-1)-
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1)HmDm的电子式__________。
(2)Cm-、E(m-1)-的还原性强弱顺序为__________(用离子符号表示),能证明其还原性强弱的离子方程式为____________________。
(3)写出B单质与A元素的最高价氧化物对应水化物的溶液反应的离子方程式___________________。
(4)用于判断C和D非金属性强弱的依据是__________
A.气态氢化物的稳定性 B.置换反应 C.与氢气化合难易程度
D.最高价含氧酸的酸性 E.得电子数目多少
F.两单质在自然界的存在形式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将A和B各0.32 mol充入恒容密闭容器中,发生反应:A(g)+B(g)![]() 2C(g) △H=-a kJ·mol-1 (a>0),反应过程中测定的数据如下表,下列说法正确的是( )
2C(g) △H=-a kJ·mol-1 (a>0),反应过程中测定的数据如下表,下列说法正确的是( )
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A.若起始时向容器中充入0.64 mol C,则达平衡时吸收的热量为0.12a kJ
B.恒温, 如果压缩容器体积,B的浓度和体积分数均不变
C.若起始时向容器中充入 0.64 mol A 和 0.64 mol B, 则达平衡时 n(C)<0.40 mol
D.恒温、恒容,向平衡体系中再充入0.32 mol A,再次平衡时,B的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,RO![]() 与R-可发生反应:RO
与R-可发生反应:RO![]() +5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
A. R2在常温常压下一定是气体 B. RO![]() 中的R只能被还原
中的R只能被还原
C. 元素R位于周期表中第ⅤA族 D. 若1 mol RO![]() 参与该反应,则转移电子的物质的量为5 mol
参与该反应,则转移电子的物质的量为5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
Y | 地壳中含量最高的元素 |
Z | 存在质量数为23,中子数为12的核素 |
W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)R在元素周期表中的位置为______;X、Z、W三种元素的原子半径从大到小的顺序是________(用元素符号表示)。
(2)X与氢两元素按原子数目比1∶3和2∶4构成分子A和B,A的催化氧化方程式为_______;B的结构式为_______;化合物Z2Y中存在的化学键类型为________。
(3)W溶于Z的最高价氧化物的水化物的离子方程式_______________。
(4)用RCl3溶液腐蚀铜线路板的离子方程式为______。检验溶液中R3+常用的试剂是________,可以观察到的现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn(OH)2可溶于氨水生成[Zn(NH3)4]2+: Zn(OH)2+4NH3·H2O=Zn(NH3)4]2++4H2O+2OH-
(1)原子序数比Zn元素小1的元素符号为____,该元素原子基态核外电子排布式为______。
(2)NH3、H2O的沸点均高于同族元素氢化物的沸点,是因为________。
(3)NH3中N原子轨道的杂化类型是______。
(4)与H2O分子互为等电子体的分子为_____。
(5)闪锌矿是一种自然界含Zn元素的矿物,其晶体结构属于立方晶体(如右图所示),则在立方ZnS晶体结构中S2-的配位数为________。Zn2+的分数坐标为(l/4,l/4,l/4)、(3/4, 3/4,l/4)、(3/4,l/4,3/4)、(1/4,3/4,3/4),则S2-的分数坐标为______。
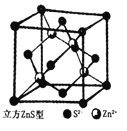
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)
Ⅰ.某温度下,0.1 mol/L的氢硫酸溶液中存在平衡:
①H2S(aq)![]() H+(aq)+HS-(aq);②HS-(aq)
H+(aq)+HS-(aq);②HS-(aq)![]() H+(aq)+S2-(aq);
H+(aq)+S2-(aq);
(1)氢硫酸溶液中存在的离子有 。(不完整不给分)
(2)若向H2S溶液中( )
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH增大
C.滴加新制氯水,平衡向左移动,溶液pH减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
Ⅱ.25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH的电离平衡常数表达式 。
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为 。
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是 。
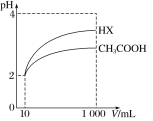
Ⅲ.在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
)=c(Cl-),则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com