
| A、离子积是1.0×10-15 |
| B、温度改变,其离子积不变 |
| C、在液氨中加入NaNH2晶体,则c(NH4+)将减少,离子积不变 |
| D、在液氨中加入NH4Cl晶体,则c(NH4+)将增大,离子积增加 |


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
A、 可以测量锌粒与硫酸的反应速率 |
B、 可以进行中和热的测定实验 |
C、 可验证温度对化学平衡的影响 |
D、 可研究催化剂对化学反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
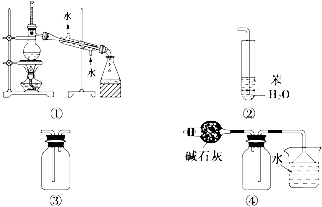
| A、装置①常用于分离乙醇或苯等与水组成的混合物 |
| B、装置②可用于吸收NH3或HCl气体,并防止倒吸 |
| C、装置③可用于收集H2、CO2、Cl2、NO等气体 |
| D、装置④可用于干燥、收集氨气,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为10mL一定物质的量浓度的盐酸(HCl),用一定浓度的NaOH溶液滴定的图示,依据图示推出HCl和NaOH的物质的量浓度是( )
如图为10mL一定物质的量浓度的盐酸(HCl),用一定浓度的NaOH溶液滴定的图示,依据图示推出HCl和NaOH的物质的量浓度是( )| 选项 | A | B | C | D |
| HCl物质的量浓度(mol/L) | 0.12 | 0.04 | 0.03 | 0.09 |
| NaOH物质的量浓度(mol/L) | 0.04 | 0.12 | 0.09 | 0.03 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(HCl)<c(NH3?H2O) |
| B、某溶液中只存在Cl-、OH、NH4+、H+四种离子,则一定不存在下列关系:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C、将0.2 mol?L-1的某一元酸HA溶液和0.1 mol?L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:2c(OH-)+c(A-)=2c(H+)+c(HA) |
| D、某物质的溶液中由水电离出的c(H+)=1×10-amol?L-1,则溶液的pH一定为14-a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、透闪石的化学式写成氧化物的形式为:2CaO?5MgO?8SiO2?H2O |
| B、透闪石的化学式写成硅酸盐的形式为:2CaSiO3?5MgSiO3?H2SiO3 |
| C、透闪石中Mg元素的质量分数是Ca元素质量分数的2倍 |
| D、透闪石中还可能有少量的Al代替Mg,Na、K、Mn代替Ca、Mg等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水中:NH4+、Fe2+、SO42-、HSO3- |
| B、pH=l的溶液中:Mg2+、Fe3+、Cl-、NO3- |
| C、通入足量CO2的溶液中:Ca2+、Na+、CO32-、SiO32- |
| D、水电离产生的c(H+)=1×10-14 mol?L-1的溶液中:Al3+、K+、Cl、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | T(℃) |
| P(MPa) | ||
| 1 | 150 |
| 0.1 | ||
| 2 | a |
| 5 | ||
| 3 | 350 | b | 5 |
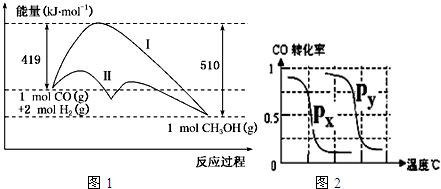
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在18 g 18O2中含有NA个氧原子 |
| B、标准状况下,22.4 L空气含有NA个单质分子 |
| C、1 mol Cl2参加反应转移电子数一定为2 NA |
| D、含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com