
A.Cl2溶于水 B.制漂白粉 C.实验室制HCl D.实验室制Cl2
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:阅读理解
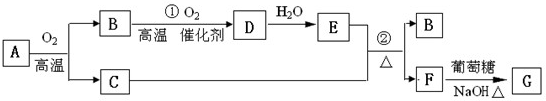
| ||
| ||
 还原型(无色)
还原型(无色)查看答案和解析>>
科目:高中化学 来源: 题型:
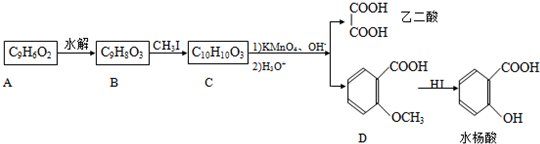
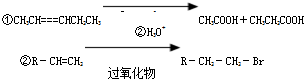
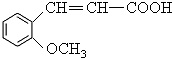
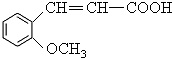
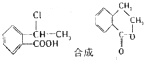
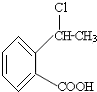 合成
合成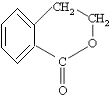 的反应流程图,请在方框内写出A与B的结构简式,并注明反应②④的条件和试剂.
的反应流程图,请在方框内写出A与B的结构简式,并注明反应②④的条件和试剂.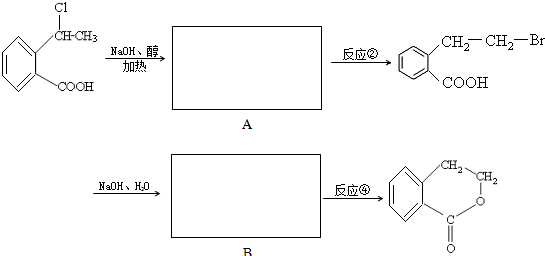
查看答案和解析>>
科目:高中化学 来源: 题型:

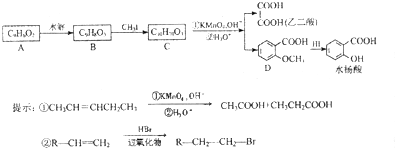
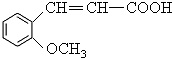
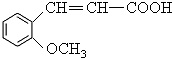
 (用反应流程图表示,并注明反应条件).
(用反应流程图表示,并注明反应条件).| 浓硫酸 |
| 170℃ |
| 高温、高压 |
| 催化剂 |
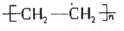
查看答案和解析>>
科目:高中化学 来源: 题型:
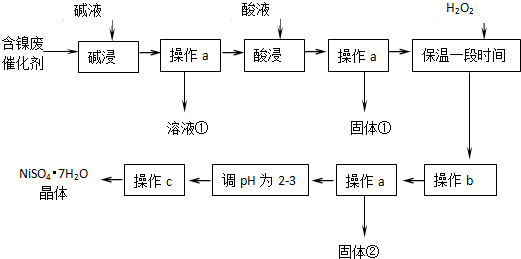
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
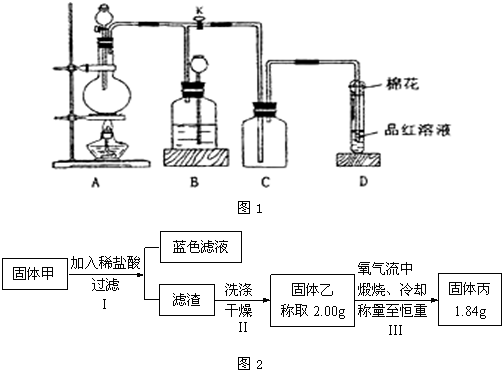
| ||
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com