
(2011?郑州二模)利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,且其中只存在OH
一、H
+、
N、Cl
一四种离子,且c(
N)>c(Cl
-)>c(OH
-)>c(H
+),则这两种溶质是
NH4Cl和NH3?H2O
NH4Cl和NH3?H2O
.
(2)0.1mol?L
-1的氨水与0.05mol?L
-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:
NH
4++H
2O

NH
3?H
2O+H
+NH
4++H
2O

NH
3?H
2O+H
+.
(3)已知:K
sp(RX)=1.8×10
-10,K
sp(RY)=1.5×10
-16,K
sp(R
2Z)=2.0×10
-12,则难溶盐RX、RY和R
2Z的饱和溶液中,R
+浓度由大到小的顺序是
R2Z>RX>RY
R2Z>RX>RY
.
(4)以石墨电极电解100mL 0.1mol?L
-1CuSO
4溶液.若阳极上产生气体的物质的量为0.01mol,则阴极上析出Cu的质量为
0.64
0.64
g.
(5)向20mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)
2溶液,生成BaSO
4的量如图所示,B点溶液的pH=7(假设体积可以直接相加),则c(HCl)=
0.2
0.2
mol?L
-1.
(6)在温度、容积相同的3个密闭容器中,按下表投入反应物,发生反应(H
2(g)+
I
2(g)?2HI(g)△H=-14.9kJ?mol
-1),在恒温、恒容条件下,测得反应达
到平衡时的数据如下表:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1mol H2、1mol I2 |
2 mol HI |
4 mol HI |
| HI的浓度(mol?L-1) |
C1 |
C2 |
C3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 反应物转化率 |
a1 |
a2 |
a3 |
下列说法正确的是
AC
AC
.
A.α
1+α
2=1 B.2α
2=α
3 C.a+b=14.9 D.c
1=c
2=c
3.

 (2011?郑州二模)利用所学化学反应原理,解决以下问题:
(2011?郑州二模)利用所学化学反应原理,解决以下问题: NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+,
NH3?H2O+H+, NH3?H2O+H+;
NH3?H2O+H+; 2HI(g)△H=-14.9kJ?mol-1,由表中数据判断:
2HI(g)△H=-14.9kJ?mol-1,由表中数据判断:

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案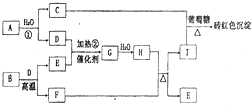 (2011?郑州二模)如图为物质A?I的转化关系(部分反应物、生成物没有列出).其中B为某金屑矿的主要成分,经过一系列反应可得到E和F.D、E常温下为气体,D、F为常见单质,
(2011?郑州二模)如图为物质A?I的转化关系(部分反应物、生成物没有列出).其中B为某金屑矿的主要成分,经过一系列反应可得到E和F.D、E常温下为气体,D、F为常见单质,