
【题目】将3.8 g CO和H2混合气体,在足量的氧气中燃烧,产物全部通过足量的Na2O2,则Na2O2增重
A. 2 g B. 3.8 g C. 5 g D. 无法计算
【答案】B
【解析】
CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应:2CO+O2![]() 2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2![]() 2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应:2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重△m=4NaOH-2Na2O2=2H2,可知反应后固体增加的质量为氢气质量;所以Na2O2增重的质量为CO与H2混合气体的质量,共3.8g,答案选B。
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应:2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重△m=4NaOH-2Na2O2=2H2,可知反应后固体增加的质量为氢气质量;所以Na2O2增重的质量为CO与H2混合气体的质量,共3.8g,答案选B。


科目:高中化学 来源: 题型:
【题目】我国考古人员在秦陵挖掘的宝剑,到现们还是锋利无比,原因是剑锋上面覆盖了一层铬。
(1)写出Cr的外围电子排布式_______。与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是__________。
(2)根据下表Cr原子的能级电离能(I:k]/mo1)数据,解释原子逐级电离能增大的原因:_______。
I1 | I2 | I3 | I4 | I5 | I6 | I7 |
652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 | 15455 |
(2)CrCl3·6H2O有三种水合异构体,蓝绿色的[Cr(H2O)5C1]Cl2·6H2O,绿色的[Cr(H2O)4C12]Cl·6H2O和紫色的______,其中Cr的配体水分子也可以被NH3置换,如[Cr(NH3)5Cl]2+,则NH3的VSEPR模型为_____,N的杂化方式为________,写出NH3的一种等电子体___________。
(4)CrO3能将CH3CH2OH氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是___________。
(5)Cr晶体的堆积模型是体心立方堆积。
①下列金属晶体也采取这种堆积模型的是__________
A.NaB.PoC.MgD.Cu
②晶胞中Cr的配位数为_________
③已知Cr的相对原子质量为M,Cr的密度为ρg/cm3,阿伏加德罗常数用NA表示,则Cr的原子半径是__pm.(写出表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁钉在氯气中被锈蚀为棕褐色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。在Cl2、Cl-、H+中,具有氧化性的是____________,其中氧化性最强的是____________。
(2)盐酸在不同的反应中可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,请写出盐酸在三个反应中分别起何种作用:
①Zn+2HCl===ZnCl2+H2↑____________________;
②NaOH+HCl===NaCl+H2O__________________;
③2HCl![]() H2↑+Cl2↑________________________。
H2↑+Cl2↑________________________。
(3)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成浅绿色溶液(FeCl2);向浓盐酸中滴加KMnO4溶液产生淡黄绿色气体(Cl2)。在Cl2、H+、![]() 中,__________________氧化性最强。
中,__________________氧化性最强。
(4)高锰酸钾与氢溴酸溶液可以发生下列反应:2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O。其中还原剂是________________。若消耗15.8 g氧化剂,则被氧化的还原剂的质量是______________g。HBr的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铜易溶于水,在130℃时会发生分解反应,是一种燃烧催化剂。以食盐等为原料制备高氯酸铜[Cu(ClO4)2·6H2O]的一种工艺流程如下:

(1)发生“电解I”时,所用的交换膜是_______________(填“阳离子交换膜”或“阴离子交换膜”)。
(2)歧化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为NaClO3。
①“歧化反应”的化学方程式为____________________________。
②“歧化反应”阶段所采用的不同温度对产率影响的结果如图所示。则该反应最适宜的温度是___。

(3)“电解II”的阳极产物为______________(填离子符号)。
(4)操作a的操作名称是_______,该流程中可循环利用的物质是_____________(填化学式)。
(5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为at,最终制得的Cu(ClO4)2·6H2O为bt,则产率为__________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的三种一元碱XOH、MOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示。下列叙述错误的是
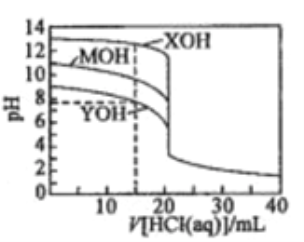
A. XOH为强碱,MOH、YOH均为弱碱
B. V[HCl(aq)]=15.00mL时,三种溶液中离子总浓度大小顺序:XOH>MOH>YOH
C. V[HCl(aq)]=20.00mL时,三种溶液中水的电离程度:XOH>MOH>YOH
D. V[HCl(aq)]=40.00ml.时,YOH溶液中:c(H+)=c(Y+)+c(OH-)+2c(YOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气的制取与储存是氢能源利用领域的研究热点。回答下列问题:
(1)直接热分解法制氢
某温度下,2H2O(g)![]() 2H2(g)+O2(g),该反应的平衡常数表达式为K=______。
2H2(g)+O2(g),该反应的平衡常数表达式为K=______。
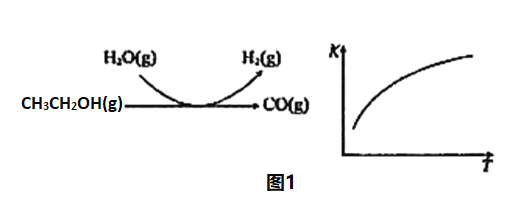
(2)乙醇水蒸气重整制氢
反应过程和反应的平衡常数(K)随温度(T)的变化曲线如图1所示。某温度下,图1所示反应每生成1molH2(g),热量变化是62kJ,则该反应的热化学方程式为_____________。
(3)水煤气法制氢
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率见图2(图中各点对应的反应温度可能相同,也可能不同)。
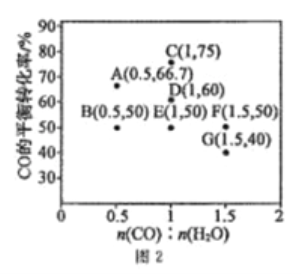
①向2L恒温恒容密闭容器中加入一定量的CO和0.1molH2O(g),在图中G点对应温度下,反应经5min达到平衡,则平均反应速率v(CO)=________。
②图中B、E两点对应的反应温度分别为TB和TE,则TB_____TE(填“>”“<”或“=”)。
③经分析,A、E、G三点对应的反应温度都相同(均为T℃),其原因是A、E、G三点对应的_________相同。
④当T℃时,若向一容积可变的密闭容器中同时充入3.0molCO、1.0molH2O(g)、1.0molCO2和x molH2,为使上述反应开始时向正反应方向进行,则x应满足的条件是______。
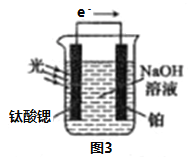
(4)光电化学分解制氢
反应原理如图3,钛酸锶光电极的电极反应式为4OH--4e-=O2↑+2H2O,则铂电极的电极反应式为________________。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数约为7.7%)。该反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是常温下,浓度为0.01mol/L的NaOH溶液与几种酸或盐混合后的情况:
混合组别 | 混合前酸或盐的总浓度 | 混合比例及混合溶液性质 |
① | c(HA)=0.02mol/L | 等体积混合,pH>7 |
② | HB溶液的pH=2 | V1mLNaOH溶液与V2mLHB溶液,pH=7 |
③ | c(H2C)=0.01mol/L | 等体积混合,pH>7 |
④ | c(NaHD)=0.01mol/L | 等体积混合,pH=7 |
回答下列问题:
(1)①组混合液中,HA、A-、Na+三种粒子浓度由大到小的顺序为________,若pH=8,则c(Na+)-c(A-)=________mol/L(填具体数字)。
(2)由②组混合液pH=7可推知,V1____V2。
(3)③组混合液中,pH>7的原因是______________________。
(4)0.01mol/LNaHD溶液中,水的电离度=_________。(已知:水的电离度=[已电离的水分子的个数/水分子总数]×100%)
(5)仅凭上述结果,一定能确定HA、HB、H2C、H2D四种酸中属于弱酸的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是短周期元素,W的一种同位素无中子,X的单质在空气中含量约占78%,Y的单质在空气中燃烧发出耀眼白光,Z的单质用于工业制漂白粉。下列说法错误的是
A. W和X形成的化合物中可能既存在极性键,又存在非极性键
B. 含氧酸的酸性Z一定大于X
C. 工业上采取电解熔融Y和Z化合物的方法冶炼Y
D. W和X的化合物与W和Z的化合物反应可产生白烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将单质Fe、Cu与FeCl3、FeCl2、CuCl2溶液一起放进某容器内,根据下述不同情况,填写金属或金属离子。
(1)充分反应后,如果Fe有剩余,则容器内不可能有_______________。
(2)充分反应后,如果容器内还有大量Fe3+,则还含有________________,一定没有________________。
(3)充分反应后,如果容器内有较多Cu2+和相当量的Cu,则容器内不可能有________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com