
分析 (1)根据n=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$结合物质的构成计算;
(2)铁与硫酸铜反应生成硫酸亚铁和铜;
(3)氢氧化钠、碳酸氢钠为强电解质,完全电离,碳酸氢钠电离层钠离子和碳酸氢根离子;
(4)碳酸钠溶液与足量稀盐酸反应生成氯化钠、二氧化碳和水.
解答 解:(1)n(H)=0.5mol×4=2mol,N(H)=2NA,V=0.5mol×22.4L/mol=11.2L,故答案为:2NA;11.2L;
(2)铁与硫酸铜溶液反应化学方程式Fe+CuSO4=Cu+FeSO4,故答案为:Fe+CuSO4=Cu+FeSO4;
(3)氢氧化钠是强碱,为强电解质,完全电离,电离方程式为:NaOH=Na++OH-,碳酸氢钠为强电解质,完在水溶液中全电离生成钠离子与 碳酸氢根离子,离子方程式:NaHCO3=Na++HCO3-;
故答案为:NaOH=Na++OH-;NaHCO3=Na++HCO3-;
(4)碳酸钠溶液与足量稀盐酸混合反应生成氯化钠、水、二氧化碳,离子反应为CO32-+2H+=H2O+CO2↑,故答案为:CO32-+2H+=H2O+CO2↑.
点评 本题考查较为综合,涉及物质的量的计算以及离子方程式的书写,为高频考点,侧重学生的分析、计算能力的考查,注意把握基本概念的理解以及相关计算公式的运用,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -285.8kJ/mol | B. | 285.8kJ/mol | C. | -241.8 kJ/mol | D. | 241.8kJ/md |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
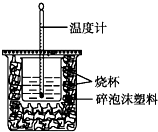 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个SO2分子所占的体积约为22.4L | |
| B. | 2.3g金属钠变为钠离子时失去的电子数目为0.1NA | |
| C. | 18g水所含的电子数目为NA | |
| D. | 标准状况下,0.3molCO2中含氧分子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com