
分析 ①反应硝酸有剩余,根据守恒守恒:2n(Cu2+)+n(H+)=n(NO3-),据此计算;
②根据N元素守恒计算NO、NO2总物质的量,再结合电子转移守恒列方程计算NO的物质的量,根据V=nVm计算NO的体积.
解答 解:①n(Cu)=$\frac{3.2g}{64g/mol}$=0.05mol,反应后溶液存在Cu2+、H+、NO3-,
其中n(Cu2+)=n(Cu)=0.05mol,n(NO3-)=amol,
根据溶液呈电中性原则,可知溶液中存在:2n(Cu2+)+n(H+)=n(NO3-),
则n(NO3-)=2×0.05mol+amol=(0.1+a)mol,
故答案为:(0.1+a);
②根据N元素守恒,NO、NO2总物质的量=0.03L×8mol/L-amol=(0.24-a)mol,
设生成的NO、NO2的物质的量分别是xmol、ymol,则:x+y=(0.24-a)
由电子转移守恒,3x+y=0.05×2,
联立方程,解得x=(0.5a-0.02)
故NO的体积为(0.5a-0.02)mol×22.4L/mol=11.2(a-0.04)L
故答案为:11.2(a-0.04).
点评 本题考查氧化还原反应计算、电荷守恒和物料守恒在解题中的应用,是对学生综合能力的考查,难度中等.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | 向Ca(HCO3)2溶液中加入少量NaOH溶液的反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 向稀HNO3中滴加Na2SO3溶液的反应:SO32-+2H+═SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的水溶液可能大量存在Fe2+、Cl-、Ca2+、Na+ | |
| B. | 滴加石蕊呈红色的溶液可能大量存在K+、NH4+、Cl-、S2- | |
| C. | 与Al反应能放出H2的溶液中可能大量存在:Fe2+、K+、NO3-、SO42- | |
| D. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下均会有气体产生,其成分中都有氧气 | |
| C. | 浓硫酸具有较强酸性,能使Cu转化为Cu2+ | |
| D. | 灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
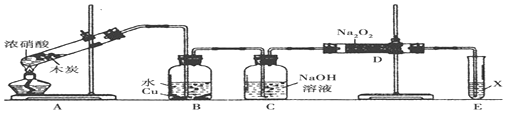
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4 g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.8 NA | |
| B. | 标准状况下,5.6 L二氧化碳气体中含有的氧原子数为0.5 NA | |
| C. | 8.7 g MnO2与40 mL 10 mol/L的浓盐酸充分反应,生成的氯气分子数为0.1 NA | |
| D. | 0.1 L 0.5 mol/L CH3COOH溶液中含有的氢离子数为0.05 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 第一步需选用仪器①、②和⑨,仪器①的名称叫坩埚 | |
| B. | 第二步用浓硝酸溶解茶叶灰,可能将Fe2+氧化成Fe3+ | |
| C. | 要完成第三步,需选用④、⑤和⑦,除夹持仪器外还缺滤纸 | |
| D. | 第四步,用试剂⑧检验滤液中的Fe3+,溶液中生成血红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2.2g | B. | 4.2g | C. | 4.4g | D. | 4.8g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com