
科目:高中化学 来源: 题型:解答题
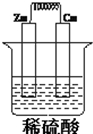 如图所示,将锌,铜通过导线相连,置于稀硫酸中构成原电池,完成下空
如图所示,将锌,铜通过导线相连,置于稀硫酸中构成原电池,完成下空查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑨ | ||||
| 3 | ① | ② | ③ | ⑦ | ⑧ |
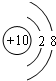 .
.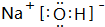 (填电子式),其所含有的化学键类型有离子键、极性共价键(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
(填电子式),其所含有的化学键类型有离子键、极性共价键(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).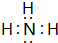 ,其水溶液呈碱性(填“酸性”、“中性”或“碱性”).
,其水溶液呈碱性(填“酸性”、“中性”或“碱性”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若能与金属钠和碳酸氢钠反应,则其结构中同时含有-OH和-COOH | |
| B. | 若该物质中含有两个-CH3,则它可以是碳酸酯 | |
| C. | 若该物质中结构中不能只含有C-O键和C-H键 | |
| D. | 若1mol C3H6O3与足量钠反应只产生1mol氢气,说明一分子C3H6O3中含有2个-OH和一个-CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海带中提取碘的氧化过程:H2O2+2I-+2H+=I2+2H2O | |
| B. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| C. | FeCl3溶液中通入过量的H2S气体:2Fe3++H2S=S↓+2Fe2++2H+ | |
| D. |  溶液通入少量CO2: 溶液通入少量CO2: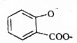 +CO2+H2O→ +CO2+H2O→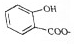 +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与NaOH溶液反应的离子方程式为:H++OH-═H2O | |
| B. | 金属钠与乙醇反应的化学方程式为:2Na+2CH3CH2OH→2CH3CH2ONa+H2↑ | |
| C. | 聚氯乙烯的结构简式为: | |
| D. | 工业上制取Cl2的离子方程式为:2Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸工业生产应考虑综合经济效益问题.
硫酸工业生产应考虑综合经济效益问题.| 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 | |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com