
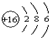 ;该元素最高正化合价与最低负化合价分别是+6和-2.
;该元素最高正化合价与最低负化合价分别是+6和-2.分析 W、X、Y、Z是原子序数依次递减的四种常见元素.X元素是地壳中含量最多的元素,则X为O元素;Y、Z组成的气态化合物可做制冷剂,其水溶液呈碱性,可推知Y为N元素、Z为H元素,M为NH3;W的单质在X2中燃烧产物可使品红溶液褪色,可推知W为S元素,以此解答该题.
解答 解:W、X、Y、Z是原子序数依次递减的四种常见元素.X元素是地壳中含量最多的元素,则X为O元素;Y、Z组成的气态化合物可做制冷剂,其水溶液呈碱性,可推知Y为N元素、Z为H元素,M为NH3;W的单质在X2中燃烧产物可使品红溶液褪色,可推知W为S元素.
(1)W为S元素,原子结构示意图是: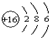 ,该元素最高正化合价与最低负化合价分别是+6、-2,
,该元素最高正化合价与最低负化合价分别是+6、-2,
故答案为: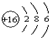 ;+6;-2;
;+6;-2;
(2)氮元素的最高价氧化物的水化物与其氢化物反应的化学方程式是:HNO3+NH3=NH4NO3,
故答案为:HNO3+NH3=NH4NO3;
(3)由以上四种元素的其中三种元素所形成的氧化物中,有一种物质能与水反应生成气体,且该反应属于氧化还原反应,该反应的化学方程式:3NO2+H2O=2HNO3+NO,反应中二氧化氮既是氧化剂又是还原剂,由还原产物NO与氧化产物硝酸的化学计量数,可知氧化剂和还原剂的物质的量之比是1:2,
故答案为:3NO2+H2O=2HNO3+NO;1:2.
点评 本题考查结构性质位置关系应用,为高考常见题型,侧重于学生的分析能力的考查,推断元素的种类是关键,熟练掌握元素化合物知识,根据化合价理解氧化还原反应基本概念.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 做“钠与水的反应”实验时,切取绿豆粒大小的金属钠,用滤纸吸干表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 | |
| B. | 用蒸馏法提纯物质时,如果把温度计水银球位于蒸馏烧瓶支管口下方,会使收集的产品中混有低沸点的杂质 | |
| C. | 制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸,加热3~5min,将导气管插入饱和Na2CO3溶液中以便于除去乙醇和乙酸 | |
| D. | 为检验皂化反应进行程度,取几滴反应液,滴入装有热水的试管中,振荡,若有油滴浮在液面上,说明油脂已完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与乙烯共1 mol,完全燃烧后生成2mol H2O | |
| B. | 光照下,异丁烷与Cl2发生取代反应生成的一氯代物有2种 | |
| C. | 乙烯可以用作生产食品包装材料的原料 | |
| D. | 乙烷室温下能与浓盐酸发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
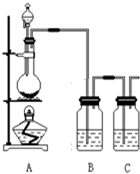 为了验证氯元素的非金属性比碘元素的非金属性强,某化学实验小组利用题中所给试剂设计了如下实验,请回答下列问题:
为了验证氯元素的非金属性比碘元素的非金属性强,某化学实验小组利用题中所给试剂设计了如下实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | C→CO2→CaCO3→CO2→C | ||
| C. | Al→Al2O3→Al(OH)3→NaAlO2 | D. | FeCO3→FeO→Fe(OH)2→Fe(OH)3→Fe2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com