
| A. | H2O2在反应①中作氧化剂,在反应②中作还原剂 | |
| B. | 在H2O2分解过程中,溶液的pH逐渐减小 | |
| C. | 在H2O2分解过程中,Fe2+起到催化剂的作用 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
分析 2Fe2++H2O2+2H+=2Fe3++2H2O中Fe元素的化合价升高,O元素的化合价降低;2Fe3++H2O2=2Fe2++O2↑+2H+中Fe元素的化合价降低,O元素的化合价升高,总反应为2H2O2═2H2O+O2↑,以此来解答.
解答 解:A.在反应①中Fe元素化合价由+3价降低为+2价,为氧化剂,在反应②中O元素的化合价由-2价升高到0价,被氧化是还原剂,故A正确;
B.总反应为2H2O2═2H2O+O2↑,溶液的H+浓度基本不变,故B错误;
C.总反应为2H2O2═2H2O+O2↑,Fe2+为H2O2分解的催化剂,故C正确;
D.Fe2+为H2O2分解的催化剂,可导致H2O2分解,所以H2O2生产过程要严格避免混入Fe2+,故D正确.
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意总反应及催化剂的判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
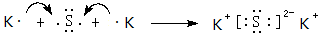 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 O2 | B. | Al(OH)3 AlCl3 | C. | FeCl3 Fe(OH)3 | D. | NaOH Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
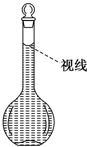 用18mol/L的浓硫酸配制80mL 1.0mol/L的稀硫酸,需用的实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
用18mol/L的浓硫酸配制80mL 1.0mol/L的稀硫酸,需用的实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 品名 | 浓缩菠萝汁 |
| 配料 | 水、浓缩菠萝汁、蔗糖、柠檬酸、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等. |
| 性质 | 亚硝酸钠 | 氯化钠 |
| 1.酸性条件下的稳定性 | 微热时分解为NO和NO2 | 微热时不分解 |
| 2.熔点 | 271℃ | 801℃ |
| 3.室温时的溶解度 | 约80g | 约35g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$ 请根据图作答:
请根据图作答: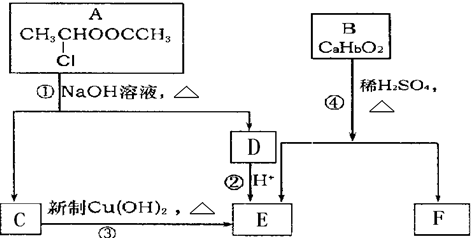

 、
、 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应结束时溶液的pH=7 | |
| B. | 反应后溶液中存在的粒子只有Na+和Cl- | |
| C. | 该反应的实质是H+和OH-结合生成水 | |
| D. | 反应前后所有元素的化合价均无变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 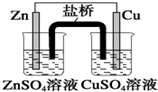 装置中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 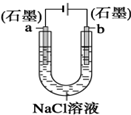 装置工作一段时间后,a极附近溶液的pH增大 | |
| C. | 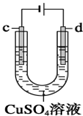 用装置精炼铜时,c极为精铜,电解过程中CuSO4溶液没有变化 | |
| D. | 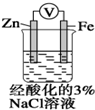 装置中电子由Zn流向Fe,装置中有Fe2+生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com