
【题目】下列说法不正确的是( )
A.用冷却结晶法来提纯含有少量氯化钾杂质的硝酸钾晶体
B.检验溶液中存在![]() 的常用方法是:往溶液中加入KSCN溶液,溶液不变色;再滴入新制氯水,溶液变成血红色
的常用方法是:往溶液中加入KSCN溶液,溶液不变色;再滴入新制氯水,溶液变成血红色
C.将石油裂化产物通入溴水中,可观察到液体分层且上下两层均为无色
D.进行淀粉水解实验时,为检验水解产物和水解是否完全,加液顺序通常如下:淀粉溶液![]() 溶液
溶液![]() 溶液
溶液![]() 碘水
碘水![]() 新制
新制![]() 悬浊液
悬浊液
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物相似。如图横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4 ]2-的物质的量浓度的对数。25℃时,下列说法中不正确的是
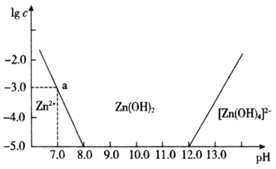
A. 往ZnCl2溶液中加入过量氢氧化钠溶液,反应的离子方程式为Zn2++4OH-=[Zn(OH)4]2-
B. 若要从某废液中完全沉淀Zn2+,通常可以调控该溶液的pH在8.0—12.0之间
C. pH=8.0与pH=12.0的两种废液中,Zn2+浓度之比为108
D. 该温度时,Zn(OH)2的溶度积常数(Ksp)为1×l0-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证还原性:SO2>Fe2+>Cl-,三组同学分别进行了下图实验,并对溶液1和溶液2中所含离子进行了检验,能证明上述还原性顺序的实验组有( )
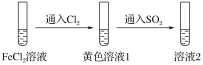
溶液1 | 溶液2 | |
甲 | 含Fe3+、Fe2+ | 含SO |
乙 | 含Fe3+,无Fe2+ | 含SO |
丙 | 含Fe3+,无Fe2+ | 含Fe2+ |
A.只有甲B.甲、乙
C.甲、丙D.甲、乙、丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各微粒浓度关系正确的是( )
A.向氨水中滴加稀硫酸至溶液呈中性:c(NH4+)=c(SO![]() )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
B.向 l00mL 3 mol/L 的 NaOH 溶液中通入标准状况下体积为 4.48L 的 CO2:3c(Na+)=2[c(CO3 2-)+c(HCO3-)+c(H2CO3)]
C.CH3COONa 溶液中加入少量 KNO3 后溶液一定有:c(Na+)+c(H+)=(CH3COO 一)+c(OH 一)
D.等物质的量浓度的①NH4HSO4、②NH4HCO3、③NH4Cl 溶液中,c(NH4+)的大小关系:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以石墨作阳极,铜棒作阴极,电解 200mL,含有 Cu2+、Fe3+离子的酸性溶液,阴极生成固体与转移电子的关系, 则以下说法正确的是( )
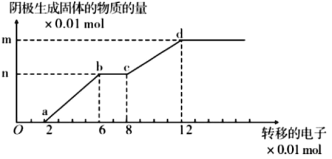
A.Oa 段、bc 段阴极均有气体产生
B.bc 段的电极反应为:Fe3++e-=Fe2+
C.原溶液 PH 值约为 1
D.该溶液中 Cu2+,Fe3+离子的浓度之比为 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。
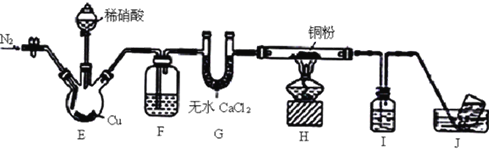
已知:在溶液中.FeSO4+NO![]() [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
A. 装置F、I中的试剂依次为水、硫酸亚铁溶液
B. 若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应
C. 实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞
D. 装置J收集的气体中一定不含NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在工业上常作为重要的化工原料,其混合气称为合成气。工业上CH4—H2O 催化重整是目前大规模制取合成气的重要方法,其原理为:
反应Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1 = +210kJ/mol
CO(g)+3H2(g) H1 = +210kJ/mol
反应Ⅱ:CO(g)+ H2O(g)![]() CO2(g)+H2(g) H2 =﹣41kJ/mol
CO2(g)+H2(g) H2 =﹣41kJ/mol
(1)CH4(g)、H2O(g)反应生成 CO2(g)、H2(g)的热化学方程式是 ___________________________。
(2)反应Ⅰ达到平衡的标志是(____________)
a.恒温恒容情况下,压强不再改变 b. v(CO):v(H2)=1:3
c.平均相对分子质量不再改变 d.恒温恒容情况下,气体密度不再改变
(3)若容器容积不变,不考虑反应Ⅰ,对反应Ⅱ下列措施可增加 CO 转化率的是(____________)
a.升高温度 b.将 CO2 从体系分离 c.充入 He,使体系总压强增大 d.按原投料比加倍投料
(4)某温度下,对于反应Ⅰ,将 n(H2O)∶n(CH4) = 1∶1 的原料气充入恒容密闭容器中,初始压强为 P0,反应达 平衡时总压强为 P1,则平衡时甲烷的转化率为 ____________________________ (忽略副反应)。
(5)将 1molCH4(g) 和 1molH2O(g)加入恒温恒压的密闭容器中(温度 298K、压强 100kPa),发生反应Ⅰ,不考虑 反应Ⅱ的发生,该反应中,正反应速率 v 正=k 正×p(CH4)×p(H2O) , 逆反应速率 v 逆=k 逆×p(CO)×p3(H2),其中 k 正、k 逆 为速率常数,p 为分压(分压=总压×物质的量分数),则该反应的压强平衡常数 Kp= ____________________________ (以 k 正、k 逆表示)。若 该条件下 k 正=4.4×104kPa-1·s-1,当 CH4 分解 20%时,v 正= ___________________________kPa·s-1(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.用坩埚灼烧![]() 的反应式
的反应式 ![]()
![]()
![]()
B.根据表中提供的数据,等物质的量浓度的NaClO、![]() 混合溶液中,有
混合溶液中,有![]()
化学式 | 电离常数 |
HClO |
|
|
|
|
C.常温下,将![]() 的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一
的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一
D.某温度时,![]() 在水中的沉淀溶解平衡曲线如图所示,溶度积常数
在水中的沉淀溶解平衡曲线如图所示,溶度积常数![]() 则加入
则加入![]() 可使溶液由a点变到b点;通过蒸发可以使溶液由d点变到c点
可使溶液由a点变到b点;通过蒸发可以使溶液由d点变到c点
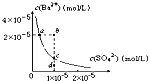
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫各微粒![]() 、
、![]() 和
和![]() 存在于
存在于![]() 与NaOH溶液反应后的溶液中,它们的物质的量分数
与NaOH溶液反应后的溶液中,它们的物质的量分数![]() 与溶液pH的关系如下图所示.下列说法正确的是
与溶液pH的关系如下图所示.下列说法正确的是
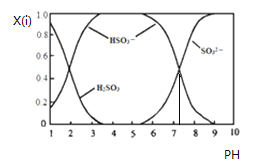
A.![]() 时,溶液中
时,溶液中![]()
B.![]() 时,溶液中
时,溶液中![]()
C.为获得尽可能纯的![]() ,可将溶液的pH控制在
,可将溶液的pH控制在![]() 左右
左右
D.由图中数据可估算出![]() 为
为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com