
【题目】滴定实验是化学学科中重要的定量实验.请回答下列问题:
Ⅰ.酸碱中和滴定﹣﹣已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250mL溶液; ②准确量取25.00mL所配溶液于锥形瓶中;③滴加几滴酚酞溶液;④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积 | 所消耗盐酸标准的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
(1)用滴定管(填“酸式”或“碱式”)盛装0.10mol/L的盐酸标准液.
(2)试样中NaOH的质量分数为 .
(3)若出现下列情况,测定结果偏高的是 .
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
(4)Ⅱ.氧化还原滴定﹣取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1molL﹣1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O.滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时滴定现象是
(5)Ⅲ.沉淀滴定﹣﹣滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是 (填选项字母).
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10﹣10 | 5.35×10﹣13 | 1.21×10﹣16 | 1.12×10﹣12 | 1.0×10﹣12 |
A.NaCl
B.NaBr
C.NaCN
D.Na2CrO4 .
【答案】
(1)酸式
(2)80%
(3)ce
(4)滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色
(5)D
【解析】解:(1)盐酸显酸性,应用酸式滴定管盛装0.10mol/L的盐酸标准液;
所以答案是:酸式;(2)三次消耗盐酸体积分别为:20.10ml、20.00ml、19.00ml,三组数据均有效,三消耗盐酸的平均体积为20.00mL,
NaOH~HCl
1 1
n(NaOH) 0.10mol/L×20.00mL
解得:n(NaOH)=0.00200mol,即25.00mL待测溶液含有m(NaOH)=nM=0.00200mol×40g/mol=0.08g,所以250mL待测溶液含有m(NaOH)=0.0800g×10=0.8g,试样中NaOH的质量分数为ω(NaOH)= ![]() ×100%=80%;
×100%=80%;
所以答案是:80%;(3)a.滴定前用蒸馏水冲洗锥形瓶,操作正确,无影响,故a错误;
b.在振荡锥形瓶时不慎将瓶内溶液溅出,造成V(标准)偏小,根据c(待测)= ![]() 分析,可知c(待测)偏小,故b错误;
分析,可知c(待测)偏小,故b错误;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,造成V(标准)偏大,根据c(待测)= ![]() 分析,可知c(待测)偏大,故c正确;
分析,可知c(待测)偏大,故c正确;
d.酸式滴定管滴至终点对,俯视读数,造成V(标准)偏小,根据c(待测)= ![]() 分析,可知c(待测)偏小,故d错误;
分析,可知c(待测)偏小,故d错误;
e.酸式滴定管用蒸馏水洗后,未用标准液润洗,溶液被稀释,造成V(标准)偏大,根据c(待测)= ![]() 分析,可知c(待测)偏大,故e正确;
分析,可知c(待测)偏大,故e正确;
故选ce;(4)KMnO4溶液呈紫色,草酸反应完毕,滴定终点时滴定现象是滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色;
所以答案是:滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色;(5)若用AgNO3去滴定NaSCN溶液,可选用的滴定指示剂的物质的溶解度应比AgSCN大,且现象明显,应为Na2CrO4 , 混合物中有砖红色沉淀生成,
所以答案是:D.
【考点精析】根据题目的已知条件,利用酸碱中和滴定的相关知识可以得到问题的答案,需要掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点.


科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验,验证元素周期律.
(1)甲同学在a、b、c三只烧杯里分别加入50mL水,再分别滴加几滴酚酞试液,依次加入大小相近的锂、钠、钾块,观察现象.①甲同学设计实验的目的是;
②反应最剧烈的烧杯是(填字母);
③写出b烧杯里发生反应的离子方程式 .
(2)乙同学设计实验验证:元素的非金属性越强,其最高价含氧酸的酸性就越强.他设计了如下图装置验证C、N、Si三种元素的非金属性强弱.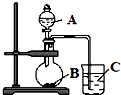
①写出所选用物质的化学式:A; B;C;
②写出圆底烧瓶中发生反应的离子方程式;
③写出烧杯中发生反应的离子方程式;
④碳、氮、硅三种元素的非金属性由强到弱顺序为;
(3)丙同学认为乙同学设计的实验不够严谨,应该在B和C之间增加一个洗气装置,该置中应盛放(填试剂).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.通常蔗糖和淀粉都不显还原性
B.用大米酿的酒在一定条件下密封保存,时间越长越香醇
C.纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应
D.纤维素分子是由葡萄糖单元组成的,可以表现出一些多元醇的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属A、B和气体甲、乙、丙及物质C、D、F、F,它们之间的转化发生如下反应,(图中有些反应的产物和反应条件没有全部标出),其中B是地壳中含量最高的金属元素,反应④在野外经常用来焊接铁轨.
请回答下列问题:
(1)写出金属A与水反应的离子方程式 .
(2)写出反应④化学方程式: .
(3)气体甲在黄绿色气体乙中燃烧的现象: .
(4)金属单质A投入到下列溶液中既有气体,又有沉淀出现的是
A.氯化钠溶液
B.碳酸钠溶液
C.硫酸铜溶液
D.氯化铵溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇结构如右式,它广泛存在于食物(例如 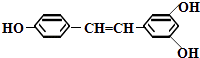 桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够与1mol该化合物起反应的Br2或H2的最大用量分别是( )
桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够与1mol该化合物起反应的Br2或H2的最大用量分别是( )
A.6mol,7mol
B.5mol,7mol
C.3.5mol,6mol
D.1mol,1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.标准状况下,22.4LCCl4含有C﹣Cl键的数目为4NA
B.取50mL 14.0mol/L浓硝酸与足量铜片反应,生成气体分子的数目为0.35 NA
C.反应NH4N3 ![]() 2N2↑+2H2↑,标准状况下每生成22.4LN2 , 转移电子的数目为2 NA
2N2↑+2H2↑,标准状况下每生成22.4LN2 , 转移电子的数目为2 NA
D.电解精炼铜时,若转移的电子数为NA个,则阳极质量减小32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物与生产、生活密切相关。下列说法不正确的是
A.天然气的主要成分是甲烷B.棉花的主要成分是淀粉
C.酒精类饮料中含有乙醇D.牛奶中含有蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下4组实验,如图Ⅰ~Ⅳ所示.
(1)Ⅱ所示的实验,若固体质量相同且稀盐酸足量时,气球鼓起较小的是(填化学式).
(2)Ⅲ、Ⅳ所示的实验均能鉴别这两种物质,相关反应的化学方程式是、 . 与Ⅲ相比,IV的优点是(填选项序号).a.Ⅳ比Ⅲ复杂 b.Ⅳ比Ⅲ安全
c.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用Ⅳ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体应该是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com